时间:2021-02-18 06:26:50
1、推断题 下图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质而I是红棕色的气态氧化物。固态物质A加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D。各物质间的转化关系如下图所示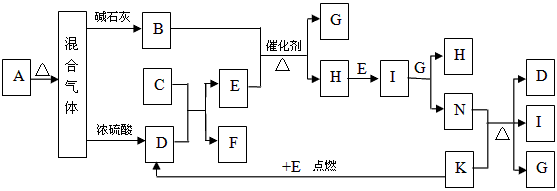
请回答下列问题
(1)写出实验室检验A物质中含有的阳离子的方法________________。
(2)B与E反应得到1molH,则此时转移电子的物质的量为_____________mol。
(3)写出实验室制取B的化学方程式_____________________________。
(4)写出N的稀溶液与过量的铁粉反应的离子方程式_____________________________。
(5)若混合气体通过碱石灰得到的气体B与通过浓硫酸得到的气体D的物质的量之比是8∶5,则用物质的量的关系表示此固体A的组成为_______________________。
2、填空题 (12分)根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为五色液体,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C的焰色反应呈黄色。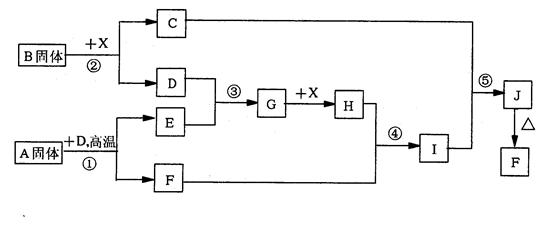
(1)化合物B中所包含的化学键有___________________
(2)反应④的离子方程式:________________________________
反应⑤的化学方程式:________________________________
(3)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
3、简答题 在如图所示转化关系中,A是一种固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.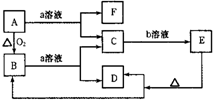 请按要求回答下列问题:
请按要求回答下列问题:
(1)若实现C→E转化所需的b溶液是“过量的盐酸”,则:B的化学式为______,属于______晶体.
(2)若实现C→E转化所需的b溶液为盐酸,但E能被过量的盐酸溶解,则:C→E的离子方程式为______;A和a溶液反应,若产生标准状态下3.36L的F气体,转移的电子数目为______个.
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,则:E的化学式为______;反应B+a→C+D的离子方程式为______.
4、简答题 已知A、B为气体单质,其中A为黄绿色气体,B为无色气体;C为化合物,其水溶液的pH小于7;D为金属单质,它们之间有下列转化关系: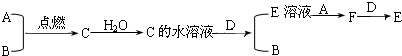
(1)试写出A、B、C、D的化学式:
A______;B______;C______;D______.
(2)写出C的水溶液与D反应的离子方程式:______;
E溶液与A反应的离子方程式:______;
F+D反应的离子方程式:______.
5、填空题 (14分)已知A、B、C、D、E是短周期中的五种非金属元素,它们的原子序数依次增大。五种元素中A元素原子半径最小;B原子的最外层电子数是内层电子数的2倍;E元素与D元素同主族;E的单质为黄色固体,自然界中游离态的E常出现在火山口附近。
(1)请写出元素符号:B?;D?。
(2)画出E的阴离子结构示意图?。
(3)B、C两种元素对应的最高价含氧酸的酸性较强的是?(填化学式)。
(4)A元素的单质和C元素的单质在一定条件下反应,生成化合物X。 X 的电子式为?,向X的水溶液中滴入石蕊试液,会观察到的现象是?。
(5)用电子式表示化合物BD2的形成过程?。
(6)向苛性钠溶液中通入过量的A2E气体时,所发生反应的离子方程式为?。
(7)化合物ED2与氯 气的水溶液充分反应可生成两种强酸,该反应的化学方程式
气的水溶液充分反应可生成两种强酸,该反应的化学方程式
为??。