时间:2021-02-18 06:22:38
1、实验题 为了验证浓度对硫酸氧化性的影响,某同学根据题目提示,选择下列仪器(仪器可以多次使用)设计实验,验证Zn+ H2SO4(稀)=ZnSO4 +H2↑;Zn +2H2SO4(浓) ZnSO4+SO2↑+2H2O,供选用的药品为18 mol/L硫酸溶液、锌粒、品红试液、溴水、酸性高锰酸钾溶液、浓硫酸、氧化铜、无水硫酸铜、碱石灰。提示:①二氧化硫具有还原性,可能与氧化铜反应;②E、F装置都使用;③同一装置可多次使用。
ZnSO4+SO2↑+2H2O,供选用的药品为18 mol/L硫酸溶液、锌粒、品红试液、溴水、酸性高锰酸钾溶液、浓硫酸、氧化铜、无水硫酸铜、碱石灰。提示:①二氧化硫具有还原性,可能与氧化铜反应;②E、F装置都使用;③同一装置可多次使用。 
(1)组合装置气流从左至右,接口连接顺序为___。
(2)D装置发生反应的离子方程式为____; C装置发生反应的化学方程式为____。
(3)E装置中药品是碱石灰,F装置中应装入____,其作用是____。
(4)证明锌与浓硫酸反应有二氧化硫产生的现象是 ____;锌与稀硫酸反应产生氢气的现象是________。
(5)简述锌与浓硫酸反应开始不产生氢气的原因是____。
参考答案:(1)b→l→k→e→f→l→k→g→b→c→d(d→c) i→j (j→i)
(2)SO2+2H2O+Br2=SO42- +2Br-+4H+? ;CuO+H2 Cu+H2O
Cu+H2O
(3)无水硫酸铜 ;检验产物水
(4)气体开始通入品红试液时,品红褪色 ;C中黑色粉末变红色,F中无水硫酸铜由白色变成蓝色
(5)浓硫酸溶液中主要含有H2SO4分子,H+很少;且+6价硫的氧化性强于H+的氧化性
本题解析:
本题难度:困难
2、实验题 利用下图装置加入适当试剂可完成某些探究实验,并得出相应实验结论。某探究小组进行某次探究实验所用试剂或所得结论列于表中,2KMnO4 +16HCl(浓)=2KCl + 2MnCl2+5Cl2↑+ 8H2O 。请回答:

⑴表中试剂①的名称是?______?,试剂②的化学式是?________?。
⑵请你根据上述实验装置再设计一个实验,比较两种物质的某种性质的强弱,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表。(设计的实验中不能再用氧化还原反应来验证氧化性顺序或还原性顺序)(所填的试剂要写名称)
参考答案:⑴①浓盐酸 , ②NaBr或KBr溶液。
⑵
? “答案不唯一”
本题解析:
本题难度:一般
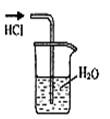
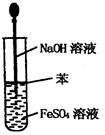
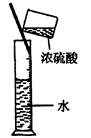
3、选择题 实验是研究化学的基础,下图所示的实验方法、装置或操作完全正确的是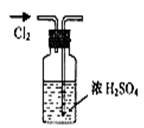
 ?
? ?
?
A.干燥Cl2
B.吸收NH3
C.制取Fe(OH)2沉淀
D.稀释浓H2SO4
参考答案:C
本题解析:略
本题难度:一般
4、实验题 某化学小组用环己醇制备环己烯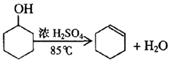
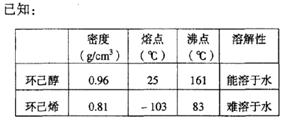
制得的环己烯粗品中含有环己醇和少量酸性杂质等。
(1)为制备环己烯精品:
①加入饱和食盐水,振荡、静置、分层,环己烯在?层(填上或下),分液后用??(填入编号)洗涤。
a.KMnO4溶液? b.稀H2SO4? c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 ?口进入。蒸馏时要加入生石灰,目的是?。
?口进入。蒸馏时要加入生石灰,目的是?。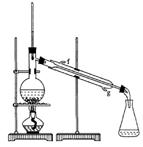
③收集产品时,控制的温度应在?左右,实验制得的环己烯精品质量低于理论产量,可能的原因是(?)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
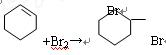
(2)在环己烯精品中滴加溴的CCl4溶液,发生反应的化学方程式?。
参考答案:(1)①上、C?②g、吸收水?③83℃、C
(2)
本题解析:略
本题难度:简单
5、选择题 甲、乙、丙、丁各是BaCl2、Na2CO3、AgNO3、HCl四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色气体;则下列判断正确的是( )
A.甲是BaCl2
B.丁是Na2CO3
C.乙是AgNO3
D.丙是HCl
参考答案:根据题意知,乙+丁→无色气体,说明乙和丁中的一种是碳酸钠,一种是盐酸;甲、乙、丁都能和丙反应生成沉淀,能和另外三种物质生成沉淀的是硝酸银,则丙是硝酸银;甲+乙→沉淀,甲是氯化钡,因为乙和丁中的一种是碳酸钠一种是盐酸,则乙是碳酸钠,所以丁是盐酸.
故选A.
本题解析:
本题难度:简单