时间:2021-02-18 06:16:44
1、填空题 分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式?;
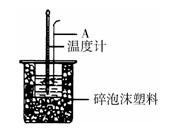
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H?(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和NaOH溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18×10-3? kJ/(g·℃)。为了计算中和热,某学生实验记录数据如下: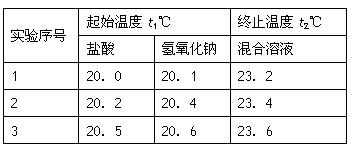 ?
?
依据该学生的实验数据计算,该实验测得的中和热△H=___________;(结果保留一位小数)
(4)若用0.50mol/L醋酸代替盐酸和氢氧化钠溶液反应则测得中和热会?(填“偏大”、“偏小”或“无影响”)。
参考答案:(1)1/2H2SO4(aq)+ NaOH (aq)="=" 1/2Na2SO4(aq)+H2O(1);△H=-57.3kJ·mol-1(2分)
(2)环形玻璃搅拌棒(1分)偏大(1分)
(3)-51.8 kJ/mol(2分)
(4)偏小(1分)
本题解析:略
本题难度:一般
2、填空题 (15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为?。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)=?。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为?? (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b?、
c?。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
?;实验a和c的平衡转化率:αa为?、αc为?。
参考答案:
⑴AX3(l)+X2(g) = AX5(s) ?ΔH=-123.8KJ·mol-1(2分)
⑵① (3 分)
(3 分)
②bca(2分) b、加人催化剂。反应速率加快,但平衡点没有改变(2分)
c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)(2分)
③α=2(1- ) (2分)? 50%(1分)?40% (1分)
) (2分)? 50%(1分)?40% (1分)
本题解析:⑴据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
⑵①
解:开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为:
AX3(g) + X2(g)? ?AX5(g)
?AX5(g)
起始时no/mol:? 0.20? 0.20? 0
平衡时n/mol:: 0.20 -x? 0.20 -x? x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10 ?
?
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g)?+? X2(g)? ?AX5(g)
?AX5(g)
起始时no/mol:? 0.20? 0.20? 0
变化量n/mol::? 0.20α? 0.20α? 0.20α
平衡时n/mol:: 0.20 -0.20α? 0.20 -0.20α? 0.20α
据题意有 ,化简得α=2(1-
,化简得α=2(1- );
);
将图中p0、p的数据代入上述计算式得αa=2(1- )=2(1-
)=2(1- )=50%;
)=50%;
αc=2(1- )=2(1-
)=2(1- )=40%。
)=40%。
本题难度:一般
3、选择题 下列属于放热反应的是(? )
A.石灰石的分解
B.焦炭和二氧化碳共热
C.钠和水反应
D.氢气还原氧化铁
参考答案:C
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以正确的答案是C。
本题难度:简单
4、选择题 下列说法或表示方法正确的是
A.由石墨比金刚石稳定可知:C(金刚石, s) = C(石墨, s) ΔH﹤0
B.强酸跟强碱反应放出的热量就是中和热
C.反应物的总能量低于生成物的总能量时,该反应一定不能发生
D.在101KPa、25℃时,1gH2完全燃烧生成气态水,放出120.9kJ热量,则氢气的燃烧热为241.8 kJ/mol
参考答案:A
本题解析:石墨比金刚石稳定,说明石墨的总能量小于金刚石的总能量,因此金刚石转化为石墨是放热反应,△H<0,选项A正确;中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以选项B不正确;反应条件与反应是放热反应或吸热反应无关系,选项C不正确;燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的温度状态是液态,选项D不正确,答案选A。
本题难度:一般
5、填空题 (4分)已知一定条件下,CO(g) + H2O (g)  ?CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为?反应(填“吸热”或“放热”),反应的热化学方程式为:?。
?CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为?反应(填“吸热”或“放热”),反应的热化学方程式为:?。
参考答案:(4分)(每空2分)
放热?CO(g) + H2O (g)  ?CO2(g) + H2(g) ; △H=—41kJ/mol。
?CO2(g) + H2(g) ; △H=—41kJ/mol。
本题解析:略
本题难度:一般