时间:2021-02-18 06:14:18
1、简答题 已知D、H是常见的非金属单质,其中H是黄绿色气体.J是一种金属单质,J元素的+2价化合物比+4价化合物稳定.D、J元素在周期表中同主族,D是形成化合物种类最多的元素.A、C是金属氧化物,C和J均是某种常见电池的电极材料,B与C反应时,每生成1mol?H同时消耗4mol?B和1mol?C.它们之间的关系如图:
(1)写出物质A的化学式______.
(2)写出反应②的化学方程式______.
(3)由金属氧化物A和C得到其相应的金属单质,在冶金工业上一般可用______方法(填序号).
①热分解法?②热还原法?③电解法
其中从A得到其相应金属也可以用铝热法,若反应中lmolA参加反应,转移电子的物质的量为______mol.
(4)用C、J作电极,与硫酸构成如图所示电池,工作时电池发生的总反应式为______,当反应转移1mol电子时,溶液中消耗H+的物质的量为______mol.
(5)向框图中的红褐色透明液体K中逐滴滴入HCl溶液.可以观察到先产生红褐色沉淀,后红褐色沉淀溶解,请解释原因______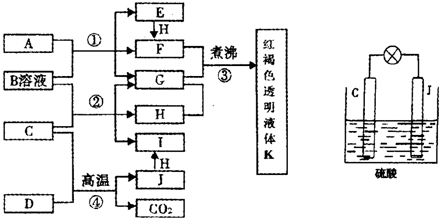
参考答案:H是黄绿色气体,为Cl2,D是形成化合物种类最多的元素,所以D是碳,D、J元素在周期表中同主族,J是一种金属单质,J元素的+2价化合物比+4价化合物稳定,所以J是Pb,C+D→Pb+CO2,C是金属氧化物,所以C是PbO,PbO+B→Cl2+G+I,B与C反应时,每生成1mol?H同时消耗4mol?B和1mol?C,根据得失电子守恒知,B是HCl,A是金属氧化物,A+盐酸→E+F+G,E和氯气反应生成F,所以A中金属元素是变价元素,为铁元素,A是四氧化三铁,E是氯化亚铁,F是氯化铁,G是水,I是PbCl2,氯化铁溶液煮沸得氢氧化铁胶体K.
(1)通过以上分析知,A是Fe3O4,故答案为:Fe3O4;
(2)二氧化铅和盐酸反应生成氯化铅、氯气和水,反应方程式为:PbO2+4HCl=PbCl2+Cl2↑+2H2O,
故答案为:PbO2+4HCl=PbCl2+Cl2↑+2H2O
(3)铁和铅属于较活泼金属,采用热还原法冶炼,故选②;
设转移电子的物质的量是x.
3Fe3O4+8Al?高温?.?9Fe+4Al2O3转移电子
3mol? 24mol
1mol?x
x=8mol
故答案为:②;8;
(4)用C、J作电极,与硫酸构成的原电池中,铅失电子,二氧化铅得电子,与硫酸反应生成硫酸铅和水,反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,
设消耗硫酸的物质的量是y.
Pb+PbO2+2H2SO4=2PbSO4+2H2O转移电子
? 2mol? 2mol
? y? 1mol
y=1mol,1mol硫酸中氢离子的物质的量是2mol,
故答案为:Pb+PbO2+2H2SO4=2PbSO4+2H2O;2;
(5)向胶体中滴加电解质溶液会产生聚沉现象,氢氧化铁又能和盐酸反应生成可溶性盐,所以沉淀会溶解,
故答案为:开始加盐酸时,氢氧化铁胶体遇电解质发生聚沉,再继续滴加则氢氧化铁沉淀与盐酸发生酸碱中和反应,沉淀溶解.
本题解析:
本题难度:一般
2、推断题 下列框图中所有反应的反应物和生成物均已列出,部分反应的反应条件未列出。其中反应①、②是工业生产中的重要反应,反应④是复分解反应,B、C、H是单质,A和D中“原子”组成个数比互为倒数,E是一种最常见的溶剂,J是一种温室气体,F的焰色反应呈黄色。I分解得到的G与J恰好能完全反应生成E和氮肥K。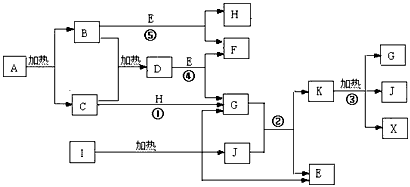
请回答下列问题
(1)A的化学式是____________;I的化学式是____________。
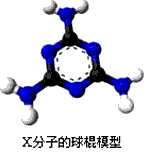
(2)G的电子式是____________。
(3)反应③的化学方程式是________________________。
(4)气体J和少量F溶液反应的离子方程式为________________________。
参考答案:(1)NaN3;(NH4)2CO3
(2)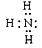
(3)6 (NH2)2CO C3H6N6+6NH3+3CO2
C3H6N6+6NH3+3CO2
(4)CO2+OH-==HCO3-
本题解析:
本题难度:困难
3、简答题 下列物质A~G是我们熟悉的单质或化合物,其中A、B均是常见的金属,E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化.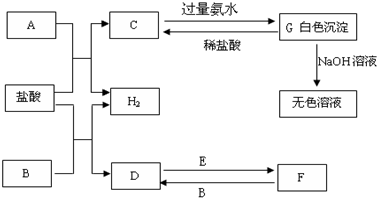
试回答下列问题:
(1)写出E的电子式______
(2)写出C→G的离子方程式______
写出沉淀G与氢氧化钠溶液反应的化学方程式______
(3)写出D→F的离子方程式并用双线桥标出电子转移方向与数目______
(4)检验F中金属阳离子的试剂(写化学式)______.
参考答案:E在常温下是黄绿色气体,E为Cl2,A、B均是常见的金属,G为白色沉淀,能溶于强碱,则G为Al(OH)3,由元素守恒及转化可知,A为Al,C为AlCl3,又由D、F的转化可知,B为变价金属,则B为Fe,D为FeCl2,F为FeCl3,
(1)由上述分析可知,E的电子数为 ,故答案为:
,故答案为: ;
;
(2)C→G的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,沉淀G与氢氧化钠溶液反应的化学方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-=AlO2-+2H2O;
(3)D→F的离子方程式并用双线桥标出电子转移方向与数目为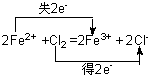 ,
,
故答案为: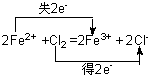 ;
;
(4)F中金属阳离子为Fe3+,遇KSCN溶液变为血红色,可利用此检验,故答案为:KSCN.
本题解析:
本题难度:一般
4、填空题 (13分)室温下,单质A为日常生活中使用最广泛的金属;单质B为黄绿色气体,单质C为常温常压下密度最小的无色气体。在合适的条件下,它们可以按如图所示进行反应,又知D溶液为黄色,E溶液为无色。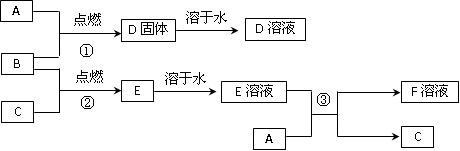
(1)写出下列物质的化学式:
D________________?; E? _________________?;? F? ____________________?。
(2) 写出F溶液在空气中与氢氧化钠溶液反应的化学方程式:____________________。
参考答案:(1)FeCl3(3分)? HCl(3分)? FeCl2?(3分)
(2)4FeCl2+8NaOH+O2 +2H2O ="8NaCl" + 4Fe(OH)3?↓?(4分)
或FeCl2+2NaOH=Fe(OH)2↓+2NaCl; 4Fe(OH)2+O2 +2H2O=4Fe(OH)3
本题解析:略
本题难度:简单
5、选择题 (单选题)某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4,其工艺流程如下: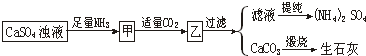
下列推断不合理的是( )
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1mol(NH4)2SO4至少消耗2molNH3
C.CO2可被循环使用
D.直接蒸干滤液能得到纯净(NH4)2SO4
参考答案:D
本题解析:
本题难度:简单