时间:2021-02-18 06:13:37
1、选择题 下列实验操作中一定会造成实验值偏小的是(? )
A.将pH试纸用蒸馏水湿润后测某溶液的pH
B.配制500mL 0.10mol/L NaCl溶液,定容时俯视
C.以标准盐酸溶液滴定未知浓度的NaOH溶液时,酸式滴定管未用标准溶液润洗
D.用标准NaOH溶液滴定未知浓度的盐酸溶液,开始时滴定管尖嘴处没有气泡,结束时有气泡
参考答案:D
本题解析:A项用pH试纸测溶液的pH时不能润湿,否则因润润湿导致溶液被稀释使所测pH不准确;B项定容时俯视液面低于刻度线,浓度偏高;C酸式滴定管未用标准溶液润洗,导致标准液浓度偏低,需要的体积偏大,待测液浓度偏高;D项测得标准液体积偏小,待测液浓度偏小。
点评:定量实验中误差分析要依据原理来分析。
本题难度:简单
2、实验题 (18分)某兴趣小组欲从工业食盐中精炼精盐,并配制NaCl溶液,请回答下列问题:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A ??B ?
(2)实验室提纯粗盐的实验操作依次为:
取样、??、沉淀、过滤、??、冷却结晶、烘干。
(3)实验室配制500 mL 0.1mol/L的NaCl溶液,具体操作步骤为:①在天平上称取一定质量的NaCl,把它放在烧杯中,用适量的蒸馏水使其完全溶解;②把制得的溶液小心的注入500 mL的容量瓶中;③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2 cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;⑤将容量瓶塞好,充分摇匀。试填写下列空白。
①应该称取的NaCl的质量为________,上述操作的正确顺序是____________;
②本实验用到的仪器除玻璃棒、托盘天平、药匙、烧杯外还需要的有___________________、______________________,
③观察容量瓶中的液面时,若俯视刻度线,会使所配的溶液的浓度________(填“偏高”“偏低”或“无影响”,下同)。没有进行操作④,会________;?
参考答案:(1)Ca(OH)2或CaO;? Na2CO3?(2)溶解;蒸发
(3)①2.9g?①②③④⑤
②500ml容量瓶、胶头滴管③偏高偏低 (每空2分)
本题解析:(1)沉淀剂A来源于石灰窑厂,则A是氢氧化钙或氧化钙。粗盐中含有钙、镁离子等杂质,所以还需要碳酸钠除去钙离子,即B是碳酸钠。
(2)过滤之前需要先溶解,要得到氯化钠晶体,需要蒸发。
(3)①500 mL 0.1mol/L的NaCl中含有0.05mol氯化钠,质量是0.05mol×58.5g/mol=2.925g,所以应该用托盘天平称量2.9g。
②准确配制一定物质的量浓度溶液时需要相应规格的容量瓶,即500ml容量瓶;定容时需要胶头滴管。
③根据c=n/V可知,俯视刻度线,则容量瓶中溶液的体积偏小,浓度偏高;如果没有洗涤,则溶质偏少,浓度偏低。
本题难度:一般
3、实验题 从环己烷可制备1,4-环己二醇的二醋酸酯,下列有关的8步反应(其中所有无机产物都已略去):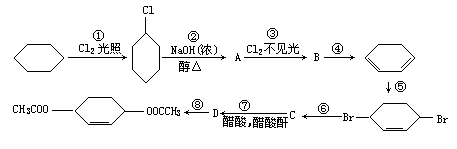
其中有3步属于取代反应,2步属于消去反应,3步属于加成反应。
反应①____和____属于取代反应。
化合物的结构简式是:B____,C_____。
反应④所用试剂和条件是_______。
参考答案: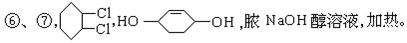
本题解析:环己烷在光照条件下发生卤代反应(取代),生成的卤代烃在NaOH醇溶液作用下发生消去反应生成环己烯(A),在不见光的条件与Cl2发生加成反应(请注意与①反应的区别)生成1,2-二氧环己烷(B),再次在NaOH醇溶液作用下发生消去反应生成1,3-环己二烯,第⑤步反应是与Br2发生加成反应(这个反应类似Br2与1,3-丁二烯发生1,4-加成)。由于反应⑦中加入醋酸与醋酸酐发生酯化反应,所以C应该是醇,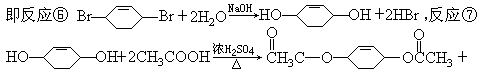
2H2O,⑧有机物与 H2发生加成反应。
本题难度:一般
4、实验题 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动: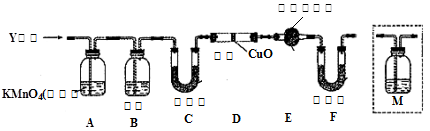
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是?
另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
(2)甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,可选用?(选填序号)。
a.KSCN溶液和氯水?b.K3Fe(CN)6溶液?c.浓氨水?d.酸性KMnO4溶液
参考答案:(10分)
(1)铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应(或其他合理答案)(2分)
(2)bd(2分)?
(3)检验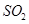 是否除尽(1分)
是否除尽(1分)
(4)C+2H2SO4(浓) CO2+2SO2+2H2O(2分)
CO2+2SO2+2H2O(2分)
(5)c(1分)
(6)D中固体由黑变红和E中固体由白变蓝(2分)
本题解析:(1)该操作使铁钉表面形成致密的氧化物薄膜,阻止铁和硫酸铜反应
(2)X中含有Fe3+,不能用a.KSCN溶液和氯水或c.浓氨水检验,而b.K3Fe(CN)6溶液和d.酸性KMnO4溶液能与Fe2+反应使溶液颜色发生变化,故本题选bd;
点评:对化学实验的考查是历年高考的重点,也是一个难点。解题的关键在于对实验基础知识的掌握,以及对基本实验流程的了解。实验的流程一般遵循“制备装置-除杂装置-性质检验装置-收集装置-尾气处理装置”。
本题难度:一般
5、填空题 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: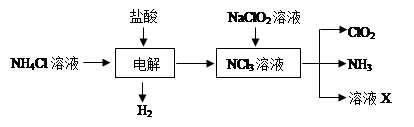
(1)除去ClO2中的NH3可选用的试剂是?;可用于制取NH3的是________(填序号)
A.饱和食盐水
B.碱石灰
C.浓硫酸
D.水 E.NH4HCO3
(2)写出NaClO2溶液与NCl3溶液反应的化学方程式:__________________
(3)写出电解时阳极发生的电极反应式_?
(4)测定ClO2的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。
①请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式?
②测得ClO2的质量m(ClO2)=?。(用含c、V的代数式表示)
参考答案:(1)C (2分);BE (2分)
(2)6NaClO2+NCl3+3H2O=6ClO2↑+NH3↑+3NaCl+3NaOH (3分)
(3)NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O (3分)
②1.35×10-2CV(g)(3分)
本题解析:(1)ClO2 易溶于水,NH3?又显碱性,因此要除去混有的氨气,应该选择浓硫酸(2分);制备氨气可以选择铵盐和强碱制备。(2分)
(2)根据已给出的反应物和生成物中化合价判断该反应是个氧化还原反应,由于有氨气产生,所以反应物必然有H2O参加,相应的就会生成NaCl 、NaOH 。
(3)电解在酸性条件下进行,阴极发生还原反应析出H2,电极反应式:6H++6e-=3H2,阳极发生氧化反应,NH4+被氧化成NCl3 ,有H+生成,电极反应式:NH4++3Cl- -6e-=NCl3+4H+(3分)
(4)ClO2?有较强氧化性,把I- 氧化为I2?,在酸性条件下,考虑有H+参加生成H2O (3分)
②根据反应方程式得出三者关系
ClO2 ~I2~S2O32-
2 : 5?:10
m(ClO2)=n(ClO2)×M(ClO2)=0.2n(S2O32-)×M(ClO2)=0.2×Cmol/L×V×10-3 L×67.5g/mol=1.35×10-2CV(g)(3分)
本题难度:一般