时间:2021-02-18 06:13:15
1、选择题 有关碳族元素的说法不正确的是(? )
A.随着原子序数的增大单质熔点逐渐升高
B.是由非金属向金属过渡的典型族
C.碳族元素的价电子是4个,介于易失电子与易得电子的元素之间,故一般不易形成离子化合物
D.除铅外它们均以+4价为稳定价态
参考答案:A
本题解析:碳族元素中单质熔点:C>Si>Ge>Pb>Sn。
本题难度:简单
2、选择题 单晶硅是信息产业中的重要基础材料,下列硅及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素②水泥、玻璃、水晶饰物都是硅酸盐制品
③陶瓷是人类应用很早的硅酸盐材料④单晶硅常用于制造光导纤维
⑤二氧化硅是沙子、石英的主要成分
A.①③⑤
B.①②④
C.③④⑤
D.①④⑤
参考答案:A
本题解析:水晶的主要成分是二氧化硅,不是硅酸盐,②不正确;二氧化硅常用于制造光导纤维,④不正确,其余选项都是正确的,答案选A。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。主要是考查学生对硅及其化合物性质和用途的熟悉掌握程度,有利于培养学生灵活运用基础知识解决实际问题的能力,也有利于培养学生的应试能力和学习效率。
本题难度:简单
3、选择题 寿山石主要成分为叶蜡石,叶蜡石组成为Al2O3·4SiO2·H2O,下列观点不正确的是( )。
A.寿山石雕刻作品要避免与酸、碱接触
B.寿山石颜色丰富多彩是因为含有不同形态的金属氧化物
C.潮湿的空气可能导致寿山石作品表面溶解变质
D.置于干燥空气中可能会导致寿山石作品脱水变质
参考答案:C
本题解析:根据寿山石的主要成分,可知其能与酸或碱发生反应,A对;寿山石中含有不同形态的Al2O3,造成其色彩丰富,B对;其中的氧化物Al2O3和SiO2不溶于水也不和水反应,不会溶解变质,C错;久置于干燥空气中,会造成其中的结晶水失去而变质,D对。
本题难度:一般
4、实验题 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝样品中可能含有碳或氧化铝中的一种杂质,现用图Ⅰ所示的装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O====NaAlO2+NH3↑,已知NH3极易溶解于水,Al在常温下能与NaOH溶液反应:2Al+2NaOH+2H2O====2NaAlO2+3H2↑。根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。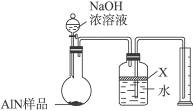
图Ⅰ
(1)实验有关操作为:
a.往圆底烧瓶中放入AlN样品w g,并向广口瓶中加入水和X液体
b.从分液漏斗往圆底烧瓶中加入一定体积的过量的浓NaOH溶液
c.检验装置的气密性
d.读取收集到水的体积
正确的操作顺序为______________________。
(2)本实验中检查装置气密性的方法是________________________。
(3)广口瓶中的试剂X可选用___________(填选项的标号)。
A.丁烷
B.酒精
C.植物油
D.CCl4
(4)实验结束后,若观察到烧瓶中还有固体,则样品中含有的杂质是________________。
(5)实验结束后,分液漏斗中的NaOH溶液已经全部加入烧瓶,量筒中收集到水的体积为a L,若当时的实验条件为标准状况,则样品中的AlN的质量分数为___________(AlN的式量为41),这一测定结果比实际值偏高,你认为可能的原因是__________________________。
(6)有人建议改用图Ⅱ装置进行同样实验,欲通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为这样的改进是否可行?________________(填“可行”或“不可行”)。理由是________________________。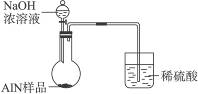
图Ⅱ
参考答案:(1)c、a、b、d
(2)关闭分液漏斗活塞,在量筒中加适量水浸没导管口,微热圆底烧瓶,量筒中产生气泡,恢复到室温时导管中形成一段液柱
(3)C? (4)碳
(5)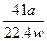 ×100%?加入的过量氢氧化钠溶液占有一定的体积,使排出的水的体积偏大
×100%?加入的过量氢氧化钠溶液占有一定的体积,使排出的水的体积偏大
(6)不可行?氨气极易被硫酸吸收,发生倒吸现象
本题解析:根据题意,该实验为一定量实验,因此按装置图连接装置后,首先要检验装置的气密性,其方法是:关闭分液漏斗活塞,在量筒中加适量水浸没导管口,使装置密闭,再微热圆底烧瓶,使装置内气体体积膨胀,若量筒中产生气泡,恢复到室温时导管中形成一段水柱,则气密性良好。由于NH3极易溶于水,因此,用NH3排水时,必须用试剂X将NH3与H2O隔开,广口瓶中的试剂X必须具备两个条件:①不与NH3、H2O反应,不溶解NH3,不溶于水;②密度比H2O小。所以试剂X可选用植物油。实验结束后,若烧瓶中还有固体,则样品中含有的杂质是碳,因为AlN和Al2O3能与NaOH溶液反应,溶解于NaOH溶液中。
由AlN+NaOH+H2O====NaAlO2+NH3↑
41 g? 22.4 L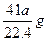 ? a L
? a L
得w(AlN)=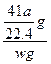 ×100%=
×100%=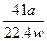 ×100%
×100%
测定结果比实际值偏高,是因为加入的过量NaOH溶液占有一定的体积,使排出的水的体积偏大,即a值偏大。
本题难度:简单
5、选择题 下列物质的用途错误的是
A.硅是制造太阳能电池的常用材料
B.常温下可用铁罐或铝罐装运稀硝酸
C.小苏打和氢氧化铝均可治疗胃酸过多
D.工厂废气中的SO2可回收生产硫酸
参考答案:B
本题解析:A正确,硅能够将太阳能转化为电能的材料;B错,常温下可用铁罐或铝罐装运浓硝酸,发生钝化;C正确,胃酸的主要成分为HCL,小苏打和氢氧化铝的碱弱较弱可以作为胃药的成分;D正确,工厂废气中的SO2可回收生产硫酸既可以消除对环境的影响,又可废物利用;
本题难度:一般