时间:2021-02-18 06:10:24
1、选择题 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是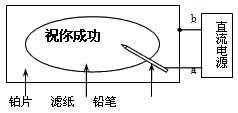
[? ]
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
参考答案:D
本题解析:
本题难度:一般
2、填空题 氯碱工业中电解饱和食盐水的原理示意图如图所示: 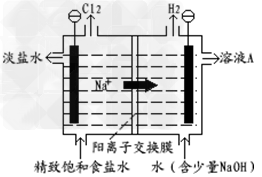
(1)溶液A的溶质是____________;
(2)电解饱和食盐水的离子方程式是________?;
(3)电解时用盐酸控制阳极区溶液的PH在2~3,用化学平衡移动原理解释盐酸的作用____________?;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。精致流程如下: 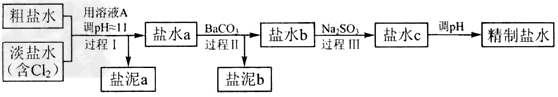
①盐泥a除泥沙外,还含有的物质是_____________。
②过程Ⅰ中将NH4+转化为N2的离子方程式是___________________?
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有_________________?
④经过程Ⅲ处理,要求盐水中c?中剩余Na2SO3的含量小于5mg?/L,若盐水b中NaClO的含量是7.45?mg?/L?,则处理10m3?盐水b?,至多添加10%?Na2SO3溶液_________?kg(溶液体积变化忽略不计)。
参考答案:(1)NaOH
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气与水反应:Cl2+H2O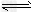 HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出
HCl+HClO,增大HCl的浓度可使平衡逆向移动,减少氯气在水中的溶解,有利于氯气的溢出
(4)①Mg(OH)2;?②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑;③SO42-、Ca2+;④1.76
本题解析:
本题难度:一般
3、填空题 工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1)下图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是_______________________;NaOH溶液的出口为___________(填字母);精制饱和食盐水的进口为________________(填字母);干燥塔中应使用的液体是________________________。 
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用收到广泛关注。①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为____________________________。②SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为_____kg。
4SiHCl3(g)达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为_____kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气_______________m3(标准状况)。
参考答案:(1)①氯气;a;d;浓硫酸
(2)①SiCl4+2H2+O2 SiO2+4HCl②0.35
SiO2+4HCl②0.35
(3)134.4
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.低碳生活倡导减少温室气体排放,CO2、CH4等是常见的温室气体
B.电解精炼铜时,当阳极质量减少3.2g时,转移的电子数为0.1×6.02×1023
C.已知反应mX(g)+nY(g) qZ(g) ,若平衡时X、Y的转化率相等,说明反应开始时X.Y的物质的量之比为1:1
qZ(g) ,若平衡时X、Y的转化率相等,说明反应开始时X.Y的物质的量之比为1:1
D.C60的摩尔质量是720
参考答案:A
本题解析:
本题难度:简单
5、实验题 食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂。按滴加顺序依次为_________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________
(2)用提纯的NaCl配制500 mL4.00 mol/L。NaCl溶液,所用仪器除药匙、玻璃棒外还有__________________(填仪器名称)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2_______(填“>”、“=”或“<”)2L,原因是____________________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________________。

 MnCl2+Cl2↑ +2H2O
MnCl2+Cl2↑ +2H2O
参考答案:(1)①BaCl2、NaOH、Na2CO3;②75%乙醇
(2)天平、烧杯、500mL容量瓶、胶头滴管
(3)<;电解生成的氯气与电解生成的NaOH发生了反应;酸碱中和滴定
(4)c;d
本题解析:
本题难度:困难