时间:2021-02-18 06:05:51
1、选择题 下列物质含原子数最多的是( )
A.8g氦气
B.标况下11.2LH2O
C.标况下22.4LNH3
D.2NA个CO2分子
参考答案:A.n(He)=8g4g/mol=2mol,
B.标况下11.2LH2O,n(H2O)=11200g18g/mol=622mol,原子的物质的量为622mol×3;
C.标况下22.4LNH3,n(NH3)=22.4L22.4L/mol=1mol,原子的物质的量为4mol;
D.2NA个CO2分子,n(CO2)=2mol,原子的物质的量为6mol,
显然B中原子的物质的量最大,则原子数最多,
故选B.
本题解析:
本题难度:一般
2、选择题 25℃ 1×105Pa下,使VL氯化氢气体溶于水的VL水溶液,关于这种溶液的叙述正确的是
[? ]
A.溶液的物质的量浓度为1mol/L
B.溶液中c(H+)= 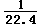 mol/L
mol/L
C.溶液中水分子数和H+数之比为1:1
D.溶液的物质的量浓度稍小于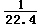 mol/L
mol/L
参考答案:D
本题解析:
本题难度:一般
3、选择题 标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为W,物质浓度为c mol/L,则下列关系中不正确的是
A.ρ=(17V+22400)/(22.4+22.4V)
B.W=17c/(1000ρ)
C.W=17V/(17V+22400)
D.c=1000Vρ/(17V+22400)
参考答案:A
本题解析::A、标准状况下VL氨气溶解在1L水中,所得溶液的质量为
V/22.4×17+1L×1000×1g·mL-1=(V/22.4×17+1000)g,所得溶液的体积为1L=1000mL,则所得溶液的密度ρ=(V/22.4×17+1000)/1000==(17V+22400)/22400;故A不正确;
B、标准状况下VL氨气溶解在1L水中,所得溶液的体积为1L,所得溶液中溶质质量="1L×c" mol·L-1×17g·mol-1="17c" g,所得溶液的质量="1L×1000×ρ" g·mL-1="1000ρ" g,则所得溶液的溶质质量分数=17c/1000ρ;故B正确;
C、标准状况下VL氨气溶解在1L水中,所得溶液中溶质质量为
V/22.4×17 g,则所得溶液的质量分数为ω=V/22.4×17÷(V/22.4×17+1L×1000×1g·mL-1)=17V/(17V+22400);故C正确;
D、标准状况下VL氨气溶解在1L水中,所得溶液的质量为(V/22.4×17+1000)g,因此所得溶液的体积为(V/22.4×17+1000)/ρmL=(V/22.4×17+1000)1000ρL,所得溶液中溶质的物质的量=V/22.4mol,则所得溶液的物质浓度为(V/22.4)÷[(V/22.4×17+1000)÷
1000ρ] =1000Vρ/(17V+22400);故D正确;
故选A.
本题难度:简单
4、选择题 现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1mol氧原子,则三种气体的物质的量之比为
A.1∶1∶1
B.1∶2∶3
C.3∶2∶1
D.6∶3∶2
参考答案:D
本题解析:CO、CO2、O3三种气体,它们含有的氧原子个数之比为1:2:3,则氧原子的物质的量相同,设都为1mol,则n(CO)=1mol,n(CO2)=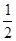 ,n(O3)=
,n(O3)= ,则这三种气体的物质的量之比为6:3:2,答案为D.
,则这三种气体的物质的量之比为6:3:2,答案为D.
考点:物质的量的有关计算
本题难度:一般
5、填空题 实验需要0.1mol/L?NaOH溶液450mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其他仪器有______.
(2)根据计算得知,所需NaOH的质量为______g.
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)偏大的有______.
参考答案:(1)没有450mL规格容量瓶,所以选用500mL容量瓶.
操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙.
根据提供的仪器可知,还需仪器有玻璃棒、胶头滴管、药匙.
故答案为:玻璃棒、胶头滴管、药匙.
(2)需氢氧化钠的质量为m=0.5L×0.1mol?L-1×40g/mol=2.0g.
故答案为:2.0g.
(3)A.称量时用了生锈的砝码,砝码质量增大,所称碳酸钠晶体质量增大,所配溶液浓度偏高;
B.将NaOH放在纸张上称量,滤纸会吸附氢氧化钠,所以转入烧杯的氢氧化钠也少了,所配溶液浓度偏低;
C.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成溶液,会导致溶液体积偏小,溶液浓度偏高;
D.往容量瓶转移时,有少量液体溅出,移入容量 瓶中的氢氧化钠的质量减小,所配溶液浓度偏低;
E.未洗涤烧杯、玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低
F.定容时,仰视刻度线,导致溶液体积增大,所配溶液浓度偏低;
G.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响.
H.摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
故选:AC
本题解析:
本题难度:一般