时间:2021-02-18 06:00:00
1、选择题 下列条件下,两物质所含分子数不相等的是
A.同温度、相同质量的N2和CO
B.常温常压,同体积的H2O和O2
C.同压强、同物质的量的N2和O2
D.同体积、同密度的N2和CO
参考答案:B
本题解析:A.根据N=nNA=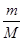 ×NA知,N2和CO的相对分子质量均为28,质量相同时,分子数一定相等;错误;B.常温常压,H2O是液体,O2是气体,相同体积时H2O所含分子数远远大于O2所含分子数,正确;C.根据N=nNA,同物质的量的N2和O2分子数一定相等;错误;D.同体积同密度的氮气和一氧化碳质量相等,由于摩尔质量相同,故物质的量相等,分子数相等,错误。
×NA知,N2和CO的相对分子质量均为28,质量相同时,分子数一定相等;错误;B.常温常压,H2O是液体,O2是气体,相同体积时H2O所含分子数远远大于O2所含分子数,正确;C.根据N=nNA,同物质的量的N2和O2分子数一定相等;错误;D.同体积同密度的氮气和一氧化碳质量相等,由于摩尔质量相同,故物质的量相等,分子数相等,错误。
考点:考查阿伏加德罗定律的应用。
本题难度:一般
2、选择题 由FeSO4和Fe2(SO4)3组成的混合物中,含硫为a%,则所含铁的质量百分含量为( )
A.3a%
B.(100-2a)%
C.20%
D.1-3a%
参考答案:FeSO4和Fe2(SO4)3中n(S):n(O)=1:4,可知混合物中硫元素与氧元素的质量比为32:16×4=1:2,混合物中含硫为a%,故混合物中氧元素质量分数=2a%,混合物中Fe元素质量分数=1-a%-2a%=1-3a%,
故选D.
本题解析:
本题难度:简单
3、选择题 用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100mL 0.1mol·L-1的稀硫酸中含有SO42—个数为0.1NA
B.1molCH3+(碳正离子)中含有电子数为10NA
C.27g金属铝与足量的盐酸反应,铝失去电子数为3NA
D.12.4g白磷(分子式为P4)中含有磷原子数为1.6NA
参考答案:C
本题解析:A错,100mL 0.1mol·L-1的稀硫酸中含有SO42—个数为0.01NA;B错,1molCH3+(碳正离子)中含有电子数为8NA;C正确;D错,12.4g白磷的物质的量为0.1mol,含有磷原子数为0.4NA
本题难度:一般
4、选择题 仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
[? ]