时间:2021-02-18 05:58:36
1、选择题 下列关于电离平衡常数(K)的说法中正确的是
A.电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为:K1<K2<K3
2、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.1mol/L氢氰酸溶液的pH约为3
B.HCN易溶于水
C.10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性比HCl溶液的弱
3、选择题 在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa混合溶液中,测得c(CH3COO-)>c(Na+)则下列关系式正确的是( )
A.c(H+)>c(OH-)
B.c(OH-)>c(H+)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02mol/L
4、选择题 常温下,用0.1000mol/L?NaOH溶液分别滴定20.00mL?0.1000mol/L?盐酸和20.00mL?0.1000mol/L?醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为?c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0?mL<V(NaOH)<20.00?mL时,对应混合溶液中各离子浓度由大到小的顺序均为?c(A-)>c(Na+)>c(H+)>c(OH-)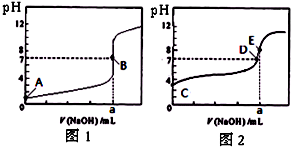
5、填空题 (12分)Ⅰ、现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________;
(2)丙溶液中存在电离平衡为______________________(用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为_________;
Ⅱ、某一元弱酸(用HA表示)在水中的电离方程式是HA