时间:2021-02-18 05:52:49
1、选择题 对于工业合成氨反应:N2+3H2 2NH3,下列表示其反应最快的是
2NH3,下列表示其反应最快的是
A.v(H2)="0.04" mol·L-1·s-1
B.v(N2)="0.02" mol·L-1·s-1
C.v(NH3)="0.02" mol·L-1·s-1
D.v(NH3)="0.03" mol·L-1·s-1
2、选择题 某化学兴趣小组欲探究反应物浓度对化学反应速率的影响,在保持其他条件都相同的情况下,使四份质量分数不同的H2O2溶液发生分解反应:2H2O2=O2↑+2H2O,其中氧气生成速率最大的是
A.5%H2O2溶液
B.10%H2O2溶液
C.20%H2O2溶液
D.30%H2O2溶液
3、选择题 决定化学反应速率的主要因素有
[? ]
A.反应温度
B.使用催化剂
C.外界压强
D.反应物的性质
4、选择题 在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如表。据此下列结论正确的是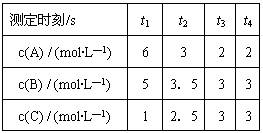
A.在t3时刻反应已经停止 B.A的转化率比B的转化率低
C.在容器中发生的反应为: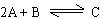
D.在t2~t3内A的平均反应速率为[1/(t3-t2)]mol/(L·s)
5、填空题 (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量。
①写出该反应的热化学方程式 。
②又已知H2O(l) = H2O(g),△H = 44 kJ/mol,则16g液态肼与液态双氧水反应生成液态水时放出的热量是
______________kJ。
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的的是_______________。
①加入少量固体碳酸钠;
②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液;
④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液;
⑥加热