时间:2021-02-18 05:50:38
1、简答题 利用下图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中.请回答:
| 实验试剂 | 实验结论 甲 乙 丙 ① 高锰酸钾 ② 氧化性:KMnO4>Cl2>Br2 | ||
| 试剂甲 | 试剂乙 | 试剂丙 | 丙中现象 | 实验结论 ______ ______ ______ ______ 酸性:盐酸>碳酸 ______ ______ 石蕊试液 ______ ______ |
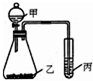
参考答案:解;(1)依据实验装置图可知,发生的反应为,甲和乙反应,生成产物通入丙中反应,如证明氧化性:KMnO4>Cl2>Br2,需要根据氧化还原反应的氧化剂的氧化性大于氧化产物的规律分析判断,甲为浓盐酸,滴入高锰酸钾溶液中生成氯气,氯气通入溴化钠溶液中会反应生成溴单质;高猛酸钾做氧化剂氧化盐酸中的氯化氢为氯气,氯气把氧化溴化钠中的溴离子为溴单质,符合氧化剂的氧化性大于氧化产物的规律应用,故答案为:浓盐酸,溴化钠溶液;
(2)实验证明盐酸>碳酸,利用酸性强弱规律设计实验,元素和大理石反应生成二氧化碳气体,使澄清石灰水变浑浊;分液漏斗中的稀盐酸滴入盛大理石的锥形瓶中,反应生成二氧化碳气体,利用丙 装置检验二氧化碳的生成,证明盐酸酸性大于碳酸;
实验设计丙为石蕊试液,甲和乙试剂反应生成气体的性质验证,气体的性质需要是特征性质的验证,可以是验证氯气在石蕊试液中的现象是先变红,后褪色;甲为浓盐酸,乙为高锰酸钾溶液,反应生成的氯气通入石蕊试液后,氯气和水反应生成盐酸和次氯酸,具有酸性和漂白性;故答案为:
本题解析:
本题难度:一般
2、选择题 已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+ Fe3++Ce3+
Sn2++2Fe3+ 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Ce3+、Fe2+、Sn2+
B.Sn2+、Ce3+、Fe2+
C.Sn2+、Fe2+、Ce3+
D.Fe2+、Sn2+、Ce3+
参考答案:C
本题解析:.由Ce4++Fe2+= Fe3++Ce3+ 可知:还原性Fe2+>Ce3+由Sn2++2Fe3+=2Fe2++Sn4+ 可知:还原性Sn2+>Fe2+
考点:了解氧化还原反应的本质是电子的转移。
点评:本题考查氧化还原反应中的强弱规律:还原剂的还原性强于还原产物的还原性。
本题难度:一般
3、选择题 已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
参考答案:C
本题解析:A、因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,A能发生;C、因该反应中Fe元素的化合价升高,碘元素的化合价降低,则Fe2+为还原剂,还原性强弱为Fe2+>I-,与已知的还原性强弱不一致,C不能发生;B、因该反应中S元素的化合价升高,I元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>I-,与已知的还原性强弱一致,B能发生;D、若该反应发生,S元素的化合价升高,O元素的化合价降低,则SO2为还原剂,还原性强弱为H2O2<SO2,与已知的还原性强弱一致,D能发生;选C。
考点:考查根据还原性强弱判断化学反应的发生。
本题难度:一般
4、选择题 已知2FeCl3?+?2KI?=?2FeCl2?+?2KCl?+?I2,H2S?+?I2?=?2HI?+?S,下列叙述正确的是
[? ]
A.?氧化性:Fe3+>I2>S?
B.?氧化性:I2>S>Fe3+
C.?还原性:Fe2+>I->H2S?
D.?还原性:Fe2+>H2S>I-
参考答案:A
本题解析:
本题难度:一般
5、实验题 为验证卤素单质氧化性的相对较弱,某小组用下图装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,A中产生黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)D中四氯化碳的电子式是?。
(2)验证氯气的氧化性强于碘的实验现象是?。
(3)B中溶液发生反应的离子方程式是?。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ?。
(5)过程Ⅲ实验的目的是?。
参考答案:(1)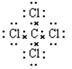 (1分)
(1分)
(2)淀粉KI试纸变蓝?(1分)?(3)Cl2+2Br- =Br2+2Cl-?(1分)
(4)打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) (2分)
静置后CCl4层溶液(或下层溶液,1分)变为紫红色。(1分)?本小题共4分
(5)确认C的黄色溶液中无Cl2,(1分)排除Cl2对溴置换碘实验的干扰。(2分)
本题解析:(1)四氯化碳是共价化合物,含有极性键,电子式是 。
。
(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,碘与淀粉性蓝色,所以实验现象是淀粉KI试纸变蓝。
(3)氯元素的非金属性强于溴元素的非金属性,所以氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br- =Br2+2Cl-。
(4)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作和现象分别是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) ,静置后CCl4层溶液(或下层溶液,1分)变为紫红色。
(5)由于氯气也能氧化碘化钾,干扰单质溴和碘化钾的反应,所以过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,注重基础知识的考查和能力的训练。该类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般