时间:2021-02-18 05:43:10
1、填空题 磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
已知:2LiAl(SiO3)2 + H2SO4(浓)  ?Li2SO4 + Al2O3·4SiO2·H2O↓
?Li2SO4 + Al2O3·4SiO2·H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

 LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:?。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为?。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:?。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为?。2、选择题 海洋中蕴藏着丰富资源,对它的开发利用有利于缓解当前资源紧张的困局,工业上从海水中提取的某些无机物的简易流程可以用下图表示: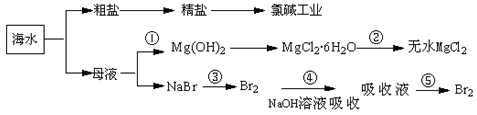
下列有关说法不正确的是
A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应
B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2
C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2
D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液
3、判断题 (10分)A是一种可以作为药物的有机化合物。请从下列反应图式中各有机物的关系(所有无机物均已略去),推测有机物A、B、C、E、F的结构简式。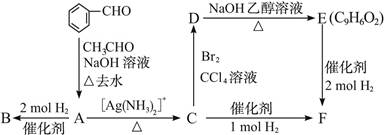
4、选择题 下列不属于传统硅酸盐产品的是
[? ]
A.玻璃
B.水泥
C.光导纤维
D.陶瓷
5、简答题 最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功.具体生产流程如下:
回答下列问题:
(1)若操作a、操作b均在实验室进行,则操作a时用到的玻璃仪器有______;进行操作b时需注意______.
(2)装置a用磷酸吸收NH3.若该过程在实验室中进行,请画出装置a的示意图.
(3)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______.
(4)固体A为生石膏(CaSO4?2H2O)和不含结晶水且高温时也不分解的杂质.生石膏在120℃时失水生成熟石膏(2CaSO4?H2O),熟石膏在200℃时失水生成硫酸钙.为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A?180g置于坩埚中加热,加热过程中固体质量随温度变化记录如图:实验中每次对固体称量时须在冷却后进行.为保证实验结果的精确性,固体冷却时必须防止______.将加热到1400℃时生成的气体通入品红溶液中,品红褪色.写出1400℃时的化学反应方程式______.③固体A中生石膏的质量分数=______.