时间:2021-02-18 05:36:21
1、选择题 下列物质的水溶液能够导电,但属于非电解质的是
A.醋酸
B.甲烷
C.二氧化硫
D.氯气
参考答案:C
本题解析:溶于水或熔融状态下能导电的化合物是电解质,溶于水和熔融状态下能不能导电的化合物是非电解质。所以A是电解质,B是非电解质。氯气是单质,既不是电解质,也不是非电解质。SO2溶于水生成亚硫酸,溶液可以导电,但SO2是非电解质。答案选C。
本题难度:一般
2、填空题
小题1: 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:
A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质。
你认为上述方案可行的是________________________________。
小题2: 一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是_____?____,②同体积同物质的量浓度的三种酸,中和同物质的量浓度的NaOH消耗的体积由大到小的顺序是_________?③当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序___________?④将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为_____________?
小题3:某温度(t ℃)时, KW=10-13,将此温度下pH=1的硫酸溶液aL与pH=12的氢氧化钡溶液bL混合。
①若所得混合液为中性,则a:b=?。
②若所得混合液的pH=2,则a:b=?。
参考答案:
小题1:ABCD
小题2:①b>a>c? ②b>a=c? ③c>a=c? ④a=b>c?
小题3: ①1:1? ②11:9
本题解析:
小题1:醋酸的浓度是0.1mol/L,若其pH大于1,氢离子浓度小于0.1mol/L,则说明醋酸没有完全电离,存在电离平衡,A可以。因为电离是吸热的,升高温度,pH变小,溶液酸性增强,说明醋酸在溶液中存在电离平衡,加热促进了醋酸的电离,B可以。若醋酸是强酸,则0.01 mol/L和0.10 mol/L的CH3COOH溶液中的pH相差1个单位,如果两者的pH相差小于1个单位,则证明存在电离平衡,C可以。酸越弱,则相应的钠盐就越容易水解,溶液的碱性就越强。所以如果醋酸钠溶液的pH大于7,则证明醋酸一定是弱酸,D正确。
小题2:①硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,所以当其物质的量浓度相同时,c(H+)由大到小的顺序是硫酸>盐酸>醋酸。
②当三种酸的体积和浓度相同时,硫酸提供的氢离子的物质的量最多,盐酸和醋酸的一样多。所以它们消耗的氢氧化钠的物质的量是硫酸>盐酸=醋酸。
③当c(H+)相同、体积相同时,盐酸和硫酸中的氢离子是相同的,生成的氢气相同。由于醋酸的浓度大于盐酸的,所以最终醋酸生成的氢气多,即硫酸=盐酸<醋酸。④强酸稀释10倍,则溶液中氢离子的浓度将变为原来的1/10。由于醋酸是弱酸,在稀释过程中会促进醋酸的电离,因此最终溶液中氢离子的浓度将小于原来的1/10。所以pH盐酸和硫酸的pH相同,都大于醋酸的pH。
小题3:考查pH的计算。硫酸和氢氧化钠混合,首先发生中和反应,生成硫酸钠和水。①若所得混合液为中性,则氢离子的物质的量和OH-的物质的量相同,即aL×0.1mol/L=bL×0.1mol/L,解得a:b=1:1。
②若所得混合液的pH=2,则说明硫酸是过量的。反应后的溶液中氢离子的浓度是0.01mol/L,则有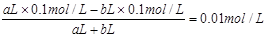 ,解得a:b=11:9。
,解得a:b=11:9。
本题难度:一般
3、选择题 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是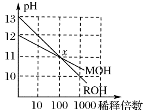
A.在x点时,ROH完全电离
B.在x点时,c(M+)>c(R+)
C.MOH是一种强碱
D.稀释前,c(ROH)=10c(MOH)
参考答案:A
本题解析:从图中可以看出,ROH稀释100倍,pH降低2,说明是强电解质,完全电离,A项正确;在x点时,pH值相等,则氢离子、氢氧根离子浓度相等,M离子和R离子浓度相等,B项错误;MOH不能完全电离,C项错误;因为MOH是弱电解质,大量没有电离,物质的量浓度大于0.01mol/L,不能确定c(ROH)与10c(MOH)的关系。
点评:通过图像要分析出是否稀释10倍,pH值下降1,来比较强弱电解质,属于简单题。
本题难度:一般
4、填空题 炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为___________________________
3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:____________________________________
4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_______________________________网
参考答案:略
本题解析:略
本题难度:一般
5、填空题 (8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ;
碳酸的第一步电离比第二步电离 (填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > >
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A.c(CH3COO-)
B.c(H+)
C.醋酸的电离平衡常数
D.醋酸的电离度
参考答案:(1)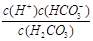 容易 (2)H2CO3 > HSO3- > HCO3- (3) A D
容易 (2)H2CO3 > HSO3- > HCO3- (3) A D
本题解析:(1)碳酸的第一步电离方程式为H2CO3 H++HCO3-,所以电离平衡常数表达式为Ka1 =
H++HCO3-,所以电离平衡常数表达式为Ka1 = 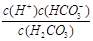 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。
本题难度:一般