时间:2021-02-18 05:32:49
1、选择题 海水的进水钢闸门易被腐蚀,对此的下列说法不正确的是
[? ]
A.钢闸门腐蚀的本质是Fe-2e-=Fe2+
B.钢闸门腐蚀主要是发生电化学吸氧腐蚀,其阴极反应是O2+2H2O+4e-=4OH-
C.将钢闸门与浸入海水的锌块用导线相连,可防止钢闸门腐蚀
D.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
2、填空题 (8分)用:NaCl做原料可以得到多种产品。
(1)工业上由NaCI制备金属钠的化学方程式是?。
(2)实验室用惰性电极电解100mL 0.1mol/LNaCl溶液。写出阳极的电极反应方程式:
?。
(3)某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱和NaCl溶液。为使Cl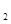 被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
被完全吸收,制得有较强杀菌能力的消毒液(“84消毒液”),设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是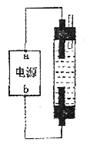
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极"b为阳极;HClO和NaCl
假设最后所得溶液中仅含一种溶质,则整个过程用一个化学方程式表示为:
?。
3、选择题 钠硫高能蓄电池的结构如图,M为Na2O和Al2O3的混合物,电池的反应原理为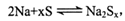 电池工作温度为320℃。下列说法错误的是
电池工作温度为320℃。下列说法错误的是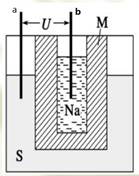
A.a为电池正极,b为电池负极
B.电池放电时,正极反应为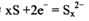
C.电池充电时.Na所在电极连接电源正极
D.M的作用为导电和隔离钠和硫
4、选择题 钢铁在空气中发生电化学腐蚀时,正极上发生的电极反应为(?)
A.Fe —3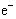 ="="
="=" 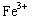
B.2H2O + O2 + 4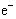 ==4OH-
==4OH-
C.Fe —2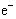 ="="
="=" 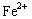
D.4OH-—4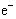 ==2H2O + O2↑
==2H2O + O2↑
5、选择题 (3分)(2012?山东)下列与金属腐蚀有关的说法正确的是( )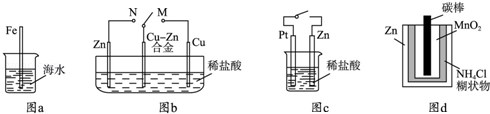
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的