时间:2021-02-18 05:32:06
1、选择题 下列生活中的化学现象与氧化还原知识有关的是?
[? ]
A.菜刀洗过后如果没擦干放置一段时间就会出现斑点
B.用食醋可以洗水垢
C.蔗糖放在水中片刻后消失了
D.稀盐酸洒在大理石台面上产生大量气泡
2、填空题 过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:
A.Ag2O+ H2O2=2Ag+O2 ↑+ H2O
B.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)写出一个H2O2既体现氧化性又体现还原性的化学反应方程式?。
(2)将下列物质:H2O2、K2SO4、MnSO4、H2SO4、KMnO4、O2的化学式分别填在空白处组成一个不需配平的化学方程式:?+ ?+______? →?+ ?+ ?+ H2O
①该反应中的还原剂是?。
②该反应中,发生还原反应的元素是?。
(3)氧化性:KMnO4_____K2CrO4(填“>”或“<”)。
3、选择题 铬是人体必需的微量元素,它与脂类代谢有密切联系,能增强人体内胆固醇的分解和排汇,但铬过量会引起污染,危害人类健康。不同价态的铬毒性不同,六价格的毒性最大,几乎是三倍铬毒性的100倍。下列叙述错误的是
A.K2Cr2O7可以氧化乙醇,所以该反应常用于检查酒后驾驶
B.污水中的铬一般为三价铬,但在溶解氧的作用下可被氧化为六价铬
C.发生铬中毒时,可用维生素C缓解性,说明维生素C具有还原性
D.配平Cr2O72-+I-+H+→Cr3++I2+H2O后,Cr3+的化学计量数是4
4、填空题 (10分) (1)用盐酸检验牙膏中有无碳酸钙的反应的离子方程式是___ _①____,往苯酚溶液中加入几滴氯化铁溶液,观察到的现象是____②____。
_①____,往苯酚溶液中加入几滴氯化铁溶液,观察到的现象是____②____。
(2)将火柴燃烧生成的气体通入盛有少量高锰酸钾酸性溶液的试管中,可以观察到的现象是____③___,说明火柴燃 烧过程中有___④____气体(填名称或符号)生成,反应中高锰酸钾是____⑤____(填“氧化剂”、“还原剂”)
烧过程中有___④____气体(填名称或符号)生成,反应中高锰酸钾是____⑤____(填“氧化剂”、“还原剂”)
(3)往盐酸酸化的FeCl2溶液中,加入NaNO2溶液,除了气体之外还能够观察到的现象是___⑥____,反应的离子方程式____⑦___,反应中NaNO2是___⑧___(填“氧化剂”、“还原剂”)。
5、填空题 氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是_________________;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2-放电产生气体的电极反应式__________________
(2)利用化学反应也能制取氟。请配平下列化学方程式
?①____K2MnF6+____SbF5→KSbF6+____MnF3+____F2↑;
②其中还原产物是__________
(3)某温度下测得浓度均为0.10 mol/L 的KF和HF混合溶液的pH=4,近似计算HF的电离平衡常数Ka(写出计算过程)。
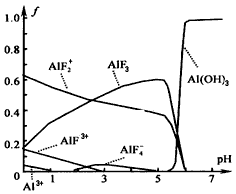
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:______________________