时间:2021-02-18 05:30:59
1、填空题 已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) △H=-570 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(l) △H=-285.6 kJ·mol-1
③C(g)+1/2O2(g)=CO (g) △H=-110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是____________(填序号)
(2)H2的燃烧热为____________,C的燃烧热为____________
(3)燃烧10gH2生成液态水,放出的热量为____________。
(4)CO的燃烧热为____________,其热化学方程式为________________________
参考答案:(1)①②③④
(2)285.6kJ·mol-1;393.5 kJ·mol-1
(3)1429kJ
(4)-283kJ·mol-1;CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1
本题解析:
本题难度:一般
2、选择题 下列叙述中的两个量,前者一定大于后者的是(?)
A.纯水在25℃和80℃时的pH
B.pH均为2的硫酸溶液和盐酸中的c(H+)
C.25℃时,0.2 mol/L与0.1 mol/L的两种醋酸溶液中醋酸的电离程度
D.25℃时,等体积且pH都等于5的盐酸和A1C13的溶液中,已电离的水分子数
参考答案:A
本题解析:水的电离为吸热过程,所以25℃纯水的离子积比80℃,即pH为前者大于后者,所以A正确;pH均为2的硫酸溶液和盐酸中的c(H+)一样大,故B错误;醋酸为弱电解质,浓度越大,电离程度越小,所以25℃时,0.2 mol/L与0.1 mol/L的两种醋酸溶液中醋酸的电离程度为后者大于前者,故C错误;25℃时,等体积且pH都等于5的盐酸和A1C13的溶液中,已电离的水分子数为或者大于前者,因为酸碱都会抑制水的电离,而盐类水解却能够促进水的电离。
点评:本题考查了水的离子积、强弱电解质、盐类水解,这些考点是高考常考的考点,本题要注意水的电离为吸热过程,温度越高,水的离子积越大,但是pH却越小。
本题难度:简单
3、选择题 下列有关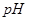 变化的判断中,错误的是
变化的判断中,错误的是
A.随着温度的升高,醋酸溶液的pH减小
B.随着温度的升高,纯水的pH增大
C.新制氯水经光照一段时间后,pH减小
D.氢氧化钠溶液久置于空气中,pH减小
参考答案:B
本题解析:PH值是以H+为计算依据来进行计算的。
A正确,温度升高,对弱酸来讲,平衡朝电离方向进行,氢离子浓度增加,PH值减小。
B错误,升高温度,促进电离,纯水的PH减小。
C正确,氯水放在光照的条件下,一段时间后,HClO分解变成HCl,溶液酸性增强,PH减小。
D正确,氢氧化钠溶液久置于空气中变质,部分变成碳酸钠,碱性减弱,PH值减小。
本题难度:一般
4、选择题 下列说法正确的是(?)
A.某溶液中所有离子的浓度大小排序是:c(CH3COO—)>c(Na+)>c(H+)>c(OH—),则该溶液的溶质一定是CH3COONa和C H3COOH
H3COOH
B .CH3COOH与NaOH的混合溶液显碱性,则溶液中各离子浓度大小排序一定为
.CH3COOH与NaOH的混合溶液显碱性,则溶液中各离子浓度大小排序一定为
c(Na+)>c(CH3COO—)>c(OH—)>c (H+)
C.常温下,a mol/L 的CH3COOH溶液与b mol/L NaOH溶液等体积混合后溶液的pH=7,则一定有a=b
D.常温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH一定等于7
参考答案:A
本题解析:略
本题难度:一般
5、填空题 在25℃时若10体积某强酸溶液与1体积的某强碱溶液混合后溶液是碱性,则混合前,该强酸的溶液的pHX与该强碱溶液的pHY之间应满足的关系是______。
参考答案:x+y>15。
本题解析:强酸[H+]=10-x,强碱中[OH-]=10-(14-y),由于酸碱混合液后[H+]<[OH-]即反应前H+的物质的量小于OH-物质的量,所以在反应前应有:1×10-(14-y)>1×10-x,即10-(14-y)>10-x,所以-(14-y)>1-x,故x+y>15。
本题难度:一般