时间:2021-02-18 05:27:46
1、选择题 实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5 ③Cr2O3和V2O5 ④Fe3O4和FeO
A.①②
B.②④
C.①④
D.②③
2、选择题 下列各项中表达正确的是(?)
A.F原子结构示意图: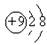
B.H2O的电子式:
C.1H、2H、3H是三种不同元素
D.乙烯的分子式: C2H4
3、填空题 写出下列化学反应的方程式
(1)实验室制取二氧化碳的反应________________________,
(2)氯气与氢氧化钠反应________________________,
(3)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)________________________。
(4)漂白粉在空气中漂白原理________________________。
4、选择题 下列说法不正确的是
A.互为同分异构体的分子结构几乎完全相同
B.丙氨酸CH3-CH(NH2)-COOH存在手性异构体
C.标准状况下,相同体积的NH3 、CH4、HF含有相同的电子数
D.等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol
5、选择题 工业上冶炼铁有化学方程式如下:Fe2O3+3CO 2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为( )
A.3