时间:2021-02-18 05:25:37
1、选择题 下列实验过程中产生的现象与对应的图形符合的是( )
A.盐酸溶液中加入NaAlO2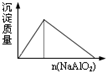
B.SO2气体通入溴水中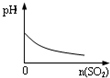
C.pH=2的醋酸与盐酸溶液分别加水稀释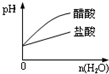
D.氨气通入醋酸溶液中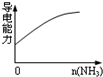
2、选择题 二氧化硫是酸性氧化物,根据其类别及化合价推测它不具有的性质
[? ]
A.与氧化钠反应
B.与氢氧化钾反应
C.与盐酸反应
D.不能被氧化成其它物质
3、填空题 现有?A.二氧化硅?B.三氧化二铁?C.?二氧化硫?D.三氧化二铝。?请你根据已有的知识,选择合适的物质,用字母代号填空:?
(1)能形成酸雨的是________?;
(2)光纤制品的基本原料__________?;
(3)属于两性氧化物的是___________;
(4)红棕色固体是?_____________?。
4、选择题 对于下列事实的解释错误的是( )
①蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性
②浓硝酸的颜色变黄,说明浓硝酸见光易分解
③SO2气体通入溴水使溴水褪色,说明SO2具有漂白性
④常温下浓硫酸可用铁槽车储运,说明常温下浓硫酸跟铁不反应.
A.①②③④
B.③④
C.只有③
D.只有④
5、选择题 下列物质在水溶液中没有漂白作用的是
[? ]
A.NaOH
B.Na2O2
C.Cl2
D.SO2