时间:2021-02-18 05:22:39
1、选择题 下列叙述正确的是( )
A.物质的量浓度均为0.1mol?L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同
B.25℃时,在CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小于7
C.在0.1mol?L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol?L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
参考答案:C
本题解析:
本题难度:简单
2、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A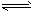 H++HA-,HA-
H++HA-,HA-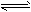 H++A2-,
H++A2-,
回答下列问题:
(1)Na2A溶液呈________(填“酸性”、“中性”或“碱性”),理由是:_______________________
(用离子方程式说明) NaHA溶液呈________(填“酸性”、“中性”或“碱性”),理由是:________________________。
(2)已知0.1mol/LNaHA溶液的pH=2,则0.1mol/L的H2A溶液中氢离子的物质的量浓度________0.11mol/L(填“<”、“>”或“==”)理由是:______________________________。
(3)0.1mol/LNaHA溶液中各种离子浓度由大到小的顺序是:________________________
参考答案:(1)碱性;A2-+H2O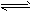 HA-+OH-;酸性;该酸式盐只能电离,导致溶液中c(H+)>c(OH-),溶液呈酸性
HA-+OH-;酸性;该酸式盐只能电离,导致溶液中c(H+)>c(OH-),溶液呈酸性
(2)<;在H2A中HA-电离受到H2A第一步电离产生的H+的影响,对HA-电离有抑制作用,导致HA-电离比NaHA中HA-电离小
(3)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是
[? ]
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
参考答案:C
本题解析:
本题难度:一般
4、推断题 W、X、Y、Z是原子序数依次增大的短周期元素。W的最外层电子数是电子层数的2倍。Y是金属,可以和X形成1︰1和2︰1两种化合物。Z的最高正价与最低负价的代数和为4。
(1)写出WX2的电子式___________________。
(2)用元素符号表示X、Y、Z原子半径由大到小的顺序_____>_____>_____。
(3)含1 mol Z的最高价氧化物对应水化物的稀溶液与足量Y的最高价氧化物对应水化物的稀溶液反应放出热量114.6 kJ,写出此反应的热化学方程式:___________________。
(4)在一定量Y的最高价氧化物对应水化物的稀溶液中通入过量WX2,用离子浓度表示该溶液中的电荷守恒____________________。
(5)Y2ZX4与WX、H2在高温和铁做催化剂条件下反应,0.1 mol Y2ZX4参加反应转移0.8 mol电子,消耗标况下H2的体积为4.48 L,该反应的化学方程式为_______________________。
参考答案:(1)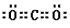
(2)Na>S>O
(3)2NaOH(aq)+H2SO4(aq) ===Na2SO4(aq) +2H2O(l) △H=-114.6kJ/mol
(4)c(HCO3-) + 2c(CO32-) + c(OH-) = c(Na+) + c(H+)
(5)Na2SO4 + 2CO + 2H2 Na2S + 2CO2 + 2H2O
Na2S + 2CO2 + 2H2O
本题解析:
本题难度:一般
5、选择题 某溶液中仅含有Na+、H+、CH3COO-、OH-四种离子,下列说法错误的是( )
A.溶液中四种离子之间可能满足:[Na+]>[OH-]>[H+]>[CH3COO-]
B.若溶液中离子浓度满足:[Na+]=[CH3COO-],则该溶液一定呈中性
C.若原溶质为CH3COONa,则[Na+]>[CH3COO-]>[OH-]>[H+]
D.若溶液中离子浓度满足[H+]>[OH-],则原溶液一定是CH3COOH和CH3COONa
参考答案:A.溶液电荷不守恒,如:[Na+]>[OH-],则[CH3COO-]>[H+],故A错误;
B.溶液中存在:[Na+]+[H+]=[CH3COO-]+[OH-],如[Na+]=[CH3COO-],则[H+]=[OH-],该溶液一定呈中性,故B正确;
C.若原溶质为CH3COONa,溶液中存在CH3COO-+H2O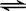 CH3COOH+OH-,则[Na+]>[CH3COO-],水解呈碱性,则[OH-]>[H+],一般来说单水解的程度较小,则[Na+]>[CH3COO-]>[OH-]>[H+],故C正确;
CH3COOH+OH-,则[Na+]>[CH3COO-],水解呈碱性,则[OH-]>[H+],一般来说单水解的程度较小,则[Na+]>[CH3COO-]>[OH-]>[H+],故C正确;
D.若溶液中离子浓度满足[H+]>[OH-],说明呈酸性,则一定存在CH3COOH,应为CH3COONa和CH3COOH的混合溶液,故D正确.
故选:A.
本题解析:
本题难度:简单