时间:2021-02-18 05:08:55
1、选择题 下列说法中正确的是
A.二氧化硫的排放会造成温室效应
B.绿色食品是不含任何化学物质的食品
C.利用丁达尔效应可区分溶液与胶体
D.用加热的方法不能鉴别NaHCO3和Na2CO3
参考答案:C
本题解析:分析:A.造成温室效应的气体是二氧化碳;
B.绿色食品指的是安全、无公害的食品;
C.胶体有丁达尔效应,溶液没有;
D.碳酸氢钠不稳定加热易分解.
解答:A.造成温室效应的气体是二氧化碳,二氧化硫是形成酸雨的主要成分,故A错误;
B.绿色食品指的是安全、无公害的食品,任何物质都是由化学物质构成的,故B错误;
C.胶体有丁达尔效应,溶液没有,故利用丁达尔效应可以区分溶液和胶体,故C正确;
D.碳酸氢钠不稳定加热易分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解,所以可以用加热方法鉴别,故D错误;
故选C.
点评:本题考查较综合,但较基础,知道形成酸雨的成分、胶体的性质,这些都是常考查点,难度不大.
本题难度:一般
2、填空题 食盐既是一种生活必需品,也是一种重要的工业原料。
(1)工业上主要通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
①写出电解饱和氯化钠溶液时的电极反应式: 阳极:___________;阴极:____________
②离子交换膜电解槽一般采用金属钛作阳极,其原因是________。阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________。
③为使电解氯化钠溶液的速度加快,下列措施不可行的是____。
A.增大阴极碳钢网的面积
B.提高饱和氯化钠溶液的温度
C.加大阴极与阳极间的距离
D.提高电解时电源的电压
(2)制取碳酸氢钠也需要大量的氯化钠。在制备碳酸氢钠时,有同学提供了下列三种生产方案,你认为哪种方案最好?____________。用此方案制取碳酸氢钠的化学反应方程式为____________________。
方案1:分别将二氧化碳和氨气通入饱和食盐水中
方案2:将二氧化碳通入含氨的NaCl饱和溶液中
方案3:将氨气通入含二氧化碳的NaCl饱和溶液中
参考答案:(1)①2Cl--2e-=Cl2↑;2H++2e-=H2↑
②阳极产生的Cl2不易腐蚀金属钛;既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免氯气和氢氧化钠溶液作用而影响烧碱的质量;③C
(2)方案2;NH3+CO2+H2O+NaCl=NaHCO3↓+ NH4Cl(或分步写:NH3+CO2+H2O=NH4HCO3,NH4HCO3+
NaCl=NaHCO3↓+NH4Cl)
本题解析:
本题难度:一般
3、填空题 请回答氯碱的如下问题
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=____________(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是________________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。 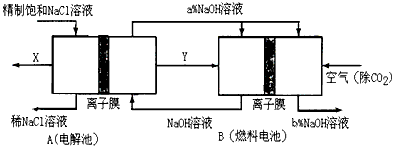
①图中X、Y分别是______________、_______________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小___________________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:_____________;负极:____________;
③这样设计的主要节(电)能之处在于(写出2处)_________________、___________________。
参考答案:(1)k=M(Cl2)/2M(NaOH)=71/80=1:1.13或0.89
(2)③①②
(3)①Cl2;H2;a%小于b%;②O2+4e-+2H2O==4OH-;H2-2e-+2OH-==2H2O;③燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度(或降低能耗)(答案合理即可)
本题解析:
本题难度:困难
4、选择题 下面物质中,不是氯碱工业的直接产品的是( ? )
A.碳酸钠
B.氢氧化钠
C.氢气
D.氯气
参考答案:A
本题解析:
本题难度:一般
5、简答题 工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
电解槽中部的阳离子交换膜把电解槽隔成了阴极室和阳极室,它只允许______(填离子符号,下同)通过,而不允许______和气体通过.电解法制碱的主要原料饱和食盐水是由粗盐制得,其中含有泥沙及Ca2+、Mg2+、Fe3+、SO42-等杂质,因此必须精制.精制时所用试剂为①NaOH②Na2CO3③BaCl2④盐酸,这四种试剂的添加顺序为______ (填序号).
氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.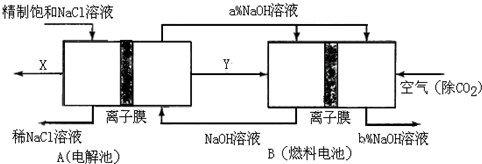
①图中X、Y分别是______、______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小______;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:______;
③这样设计的主要节(电)能之处在于(写出2处)______、______.
参考答案:(1)阳离子交换膜只允许阳离子Na+通过,不允许阴离子Cl-、OH-通过,故答案为:Na+;Cl-、OH-;
(2)先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子,如果加反了,过量的钡离子就没法除去,至于加氢氧化钠除去镁离子顺序不受限制,因为过量的氢氧化钠加盐酸就可以调节了,只要将三种离子除完了,过滤,最后加盐酸除去过量的氢氧根离子、碳酸根离子,故答案为:③②①④或①③②④;
(3)①在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%小于b%,故答案为:Cl2;H2;a%小于b%;
②燃料电池的工作原理:负极是燃料氢气发生失电子的氧化反应,即O2+4e-+2H2O=4OH-,正极是氧气发生得电子得还原反应,即H2-2e-+2OH-=2H2O,故答案为:O2+4e-+2H2O=4OH-;H2-2e-+2OH-=2H2O;
③燃料电池能将化学能转化为电能,所以燃料电池可以补充电解池消耗的电能,此外还可以提高产出碱液的浓度,降低能耗,故答案为:燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度(降低能耗).
本题解析:
本题难度:一般