时间:2021-02-18 05:08:33
1、选择题 晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右图所示,下列说法正确的是 (?)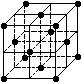
A.C60摩尔质量是720
B.C60属于离子晶体
C.在C60晶胞中有4个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
2、填空题 (12分)下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚
石、石墨结构中的某一种的某一部分
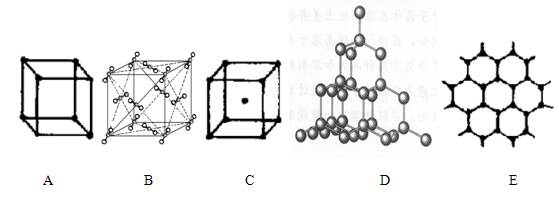
(1)其中代表金刚石的是(填编号字母,下同)?,晶体的空间最小环由?个原子构成,金刚石属于?晶体;
(2)其中代表石墨是?,其中每个正六边形占有的碳原子数平均为?个;
(3)代表干冰的是?,它属于?晶体,每个CO2分子与?个CO2分子紧邻;
(4)上述B、C、D三种物质熔点由高到低的排列顺序为?。
(5)第ⅢA、ⅤA族元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。在GaN晶体中,每个Ga原子与?个
N原子相连,与同一个Ga原子相连的N原子构成的空间构型为?。
在四大晶体类型中,GaN属于?晶体。
3、选择题 下列微粒不能结合H+的是
[? ]
A.
B.HCO3-
C.NH4+
D.H2O
4、选择题 某固体仅由一种元素组成,其密度为5.0g·cm-3。用X射线研究该固体的结构得知:在边长为10-7cm的正 方体中含有20个原子。则此元素的相对原子质量最接近于下列数据中的
[? ]
A.32
B.120
C.150
D.180
5、选择题 由非金属元素组成的化合物(? )
A.一定是共价化合物
B.一定是离子化合物
C.不可能是原子晶体
D.可能是离子晶体