时间:2021-02-18 05:06:46
1、填空题 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(s)+4CO(g)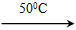 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q
②Ni(CO)4(g)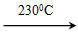 Ni(s)+4CO(g)
Ni(s)+4CO(g)
完成下列填空:
(1)在温度不变的情况下,要提高反应①中Ni(CO)4的产率,可采取的措施有____________、____________ 。
(2)若反应②达到平衡后,保持其他条件不变,降低温度,重新达到平衡时_______________?。
a.平衡常数K增大 ? b.CO的浓度减小
c.Ni的质量减小? d.v逆[Ni(CO)4]增大
(3)简述羰基法提纯粗镍的操作过程____________________________________________。
参考答案:(1)增大CO浓度 加压 (2)bc
(3)把粗镍和CO放于一个水平放置的密闭的玻璃容器中,然后在低温下反应,一段时间后在容器的一端加热
本题解析:(1)反应①是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温度不变的情况下可采取增大CO浓度,加压的方法提高产率;
(2)反应(2)是正向气体体积增大的吸热反应,则降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆[Ni(CO)4]减小;(3)根据反应①②的特点可提纯粗镍。
本题难度:一般
2、计算题 将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)  2SO3(g)?测得平衡时混合物总的物质的量为5mol,求:
2SO3(g)?测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
参考答案:(10分)
解:设平衡时SO2转化的物质的量为2a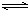 ? 2SO2(g)?+? O2(g)? 2SO3(g)
? 2SO2(g)?+? O2(g)? 2SO3(g)
起始? 4 mol? 2 mol? 0
转化? 2a? a? 2a
平衡?4-2a? 2-a? 2a
4-2a+2-a+2a=5
a=1?(6分)
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol? n(O2)="1" mol? n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L? c(O2)=0.25mol/L? c(SO3)="0.5" mol/L?(2分)
平衡时SO2的转化率="2" mol /4 mol×100%=50%?(2分)
本题解析:解:设平衡时SO2转化的物质的量为2a
2SO2(g)?+? O2(g)? ?2SO3(g)
?2SO3(g)
起始? 4 mol? 2 mol? 0
转化? 2a? a? 2a
平衡?4-2a? 2-a? 2a
4-2a+2-a+2a=5
a=1?
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol? n(O2)="1" mol? n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L? c(O2)=0.25mol/L? c(SO3)="0.5" mol/L?
平衡时SO2的转化率="2" mol /4 mol×100%=50%?
点评:本题考查了三行式的应用;对于化学平衡的计算常用此法,学生要多加练习,此类问题便不难解决。
本题难度:一般
3、选择题 同温同压下,当反应物分解了8%时,总体积也增加8%的是
[? ]
A.2NH3(g)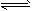 N2(g)+3H2(g)
N2(g)+3H2(g)
B.2NO(g)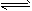 N2(g)+O2(g)
N2(g)+O2(g)
C.2NO3(g)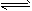 4NO2(g)+O2(g)
4NO2(g)+O2(g)
D.2NO2(g)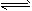 2NO(g)+O2(g)
2NO(g)+O2(g)
参考答案:A
本题解析:
本题难度:一般
4、选择题 在一定温度下,可逆反应A(g)+3B(g)  ?2C(g)达到化学平衡状态的标志是
?2C(g)达到化学平衡状态的标志是
A.单位时间生成n mol A,同时生成3n mol B
B.A、B、C的分子数比为1∶3∶2
C.A、B、C的浓度不再变化
D.C的生成速率与A的消耗速率相等
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以C正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此B不正确。A中反应速率的方向是相同的,不能说明。D中反应速率的方向相反,但不满足速率之比是相应但化学计量数之比,因此D不正确。答案选C。
本题难度:简单
5、选择题 在一定条件下,将物质的量相同的NO和O2混和,发生如下反应:2NO+O2=2NO2,2NO2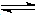 N2O4,所得混合气体中NO2的体积百分含量为40%,此时,混合气体的平均分子量为
N2O4,所得混合气体中NO2的体积百分含量为40%,此时,混合气体的平均分子量为
[? ]
参考答案:A
本题解析:
本题难度:一般