时间:2021-02-18 05:02:39
1、选择题 下列电离方程式书写正确的是
[? ]
A.NaHCO3=Na++H++CO32-
B.HF H++F-
H++F-
C.H2SO3 2H++SO32-
2H++SO32-
D.CH3COONH4 CH3COO-+NH4+
CH3COO-+NH4+
参考答案:B
本题解析:
本题难度:简单
2、选择题 下列说法中正确的是
[? ]
A.常温下,某溶液中由水电离的c(OH-)=1×10-13mol/L,则该溶液为NH4Cl溶液或NaOH溶液
B.25℃时,浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离出来的c(OH-),前者大于后者
C.1 mL pH =1的H2SO4溶液与100 mL NaOH溶液混合后所得溶液的pH=7,则NaOH溶液的pH=11
D.25℃时pH=5的CH3COOH溶液和100℃时pH=5的AlCl3溶液中的c(H+)相等
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列电离方程式中,正确的是( )
A.CH3COOH=CH3COO-+H+
B.NaOH=Na++OH-
C.KClO3?K++ClO3-
D.NaHCO3=Na++H++CO32-
参考答案:B
本题解析:
本题难度:简单
4、选择题 对水的电离平衡不产生影响的粒子是
A.Fe3+
B.Cl-
C.HCl
D.CH3COO-
参考答案:B
本题解析:H2O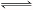 H++OH-,氢离子和氢氧根离子浓度增大,会抑制水的电离,弱酸根离子和弱碱根离子能发生水解反应,促进水的电离,故只有氯离子对水的电离无影响,答案选B.
H++OH-,氢离子和氢氧根离子浓度增大,会抑制水的电离,弱酸根离子和弱碱根离子能发生水解反应,促进水的电离,故只有氯离子对水的电离无影响,答案选B.
考点:水的电离
本题难度:一般
5、选择题 室温时,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的正确关系为
A.V(酸)=102V(碱)
B.V(碱)=102V(酸)
C.V(酸)=2V(碱)
D.V(碱)=2V(酸)
参考答案:B
本题解析:根据溶液的PH分别计算溶液中c(H+)和c(OH-),酸碱溶液混合pH=7,则说明n(H+)=n(OH-),以此进行计算,强酸溶液pH=a,则c(H+)=10-amol/L,强碱溶液pH=b,则c(OH-)=10b-14mol/L,酸碱溶液混合pH=7,则说明n(H+)=n(OH-),则有:V(酸)×10-amol/L=V(碱)×10b-14mol/L,答:碱溶液体积V(碱)和酸溶液体积V(酸)的关系为V(碱)=102V(酸)
考点:酸碱混合时的定性判断及有关pH的计算
点评:考查酸碱混合的计算,题目难度中等,注意从酸碱溶液混合pH=7,n(H+)=n(OH-)的角度解答。
本题难度:简单