时间:2021-02-18 05:00:05
1、选择题 Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A.KCl
B.Na2S
C.Na2O
D.K2S
参考答案:D
本题解析:
本题难度:一般
2、选择题 如果发现了原子序数为116的元素,对它的正确叙述是下列组合中的( )
①位于第七周期;②是非金属元素;③最外电子层含有6个电子;
④没有放射性;?⑤属于和氧同族的元素;⑥属于卤素.
A.①③⑤
B.①③⑥
C.②④⑥
D.②③⑤
参考答案:①元素周期表的前六周期已填满,所容纳的元素种数是:2+8+8+18+18+32=86,而前七周期可容纳元素的种数是:86+32=118;可见116号元素位于第七周期ⅥA族,故①正确;
②周期表总从上到下元素的金属性逐渐增强,已知第六周期的Po元素为金属元素,则第116号元素为金属元素,故②错误;
③116号元素位于第七周期ⅥA族,最外层电子数为6,故③正确;
④第六周期的Po元素具有放射性,则同主族第七周期元素也具有放射性,故④错误;
⑤116号元素位于第七周期ⅥA族,属于氧族元素,故⑤正确;
⑥116号元素位于第七周期ⅥA族,不属于卤素,故⑥错误.
故选A.
本题解析:
本题难度:一般
3、简答题 现有A、B、C、D四种短周期元素,A元素的原子半径是除稀有气体外半径最大的,B元素的原子最外层比次外层多3个电子,C元素是人体中质量分数最大的,D元素的一种核素质量数与质子数相等.请据此填空:
(1)A的原子结构示意图______;B2分子的电子式______.
(2)C元素常见单质的化学式为______、______.
(3)A与B形成的一种化合物中,A元素的质量分数为35.4%,该化合物的摩尔质量不超过70g?mol-1,则该化合物的化学式是______,其中可能有的化学键为______.
参考答案:A、B、C、D四种短周期元素,A元素的原子半径是除稀有气体外半径最大的,则A为Na;B元素的原子最外层比次外层多3个电子,两个电子层符合电子排布规律,则B为N;C元素是人体中质量分数最大的,则C为O;D元素的一种核素质量数与质子数相等,H元素的一种核素氕符合,即D为H,
(1)Na的原子结构中有3个电子层,最外层电子数为1,则原子结构示意图为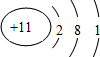
,N的最外层电子数为5,则N2的电子式为
,
故答案为: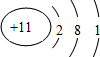
;
;
(2)氧元素形成的常见单质为O2、O3,故答案为:O2;O3;
(3)设化学式为NaxNy,则23x+14y≤70,23x(23x+14y)=35.4%,解得y≤3.2,
则x=1、y=3符合,所以化学式为NaN3,该物质中N、N之间以共价键结合,钠离子与阴离子之间以离子键结合,
故答案为:NaN3;离子键、共价键.
本题解析:
本题难度:一般
4、选择题 下列各组给定原子序数的元素,不能形成原子数之比为1:1稳定化合物的是( )
A.3和17
B.1和8
C.1和6
D.7和12
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列说法中正确的是( )
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
参考答案:A.非金属元素呈现的最高化合价等于原子最外层电子数,不超过该元素原子的最外层电子数,故A正确;
B.非金属元素呈现的最低化合价为原子最外层电子数-8,最高化合价等于原子最外层电子数,故B错误;
C.He最外层电子数为2,为非金属元素,故C错误;
D.最外层有5个电子的原子位于周期表第ⅤA族,第ⅤA元素既有金属元素也有非金属元素,故D错误.
故选A.
本题解析:
本题难度:一般