时间:2021-02-18 04:56:46
1、选择题 下列物质中,属于电解质的是
A.CO2
B.盐酸
C.BaSO4
D.酒精
参考答案:C
本题解析:分析:电解质是:在水溶液中或熔融状态下能导电的化合物,根据电解质的定义判断选项.
电解质必须符合下列条件:1、在水溶液中能导电的物质必须是原物质,不能是与水反应后的物质;2、必须是化合物.
解答:A、CO2 的水溶液能导电,但导电的不是二氧化碳是碳酸,所以二氧化碳不是电解质,故A错误.
B、盐酸是混合物,故B错误.
C、硫酸钡虽然不溶于水,但在熔融状态下能电离出自由移动的离子从而能导电,所以硫酸钡是电解质,故C正确.
D、酒精在水溶液中或熔融状态下都不能导电,所以不是电解质,故D错误.
故选C.
点评:理解电解质定义时注意:
1、在水溶液中能导电的物质必须是原物质,不能是与水反应后的物质;
2、必须是化合物;
3、不溶于水的化合物不一定不是电解质;
4、能导电的物质不一定是电解质;
5、不是电解质的物质不一定就是非电解质,如单质既不是电解质也不是非电解质.
本题难度:困难
2、选择题 下列有关化学概念或原理的论述中,正确的是( )
A.Cl2、SO2、NH3的水溶液都能够导电,因此都属于电解质
B.任何一个氧化还原反应都可以设计为电池,输出电能
C.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大
D.电解饱和食盐水的过程中,水的电离平衡正向移动
参考答案:D
本题解析:A项,SO2、NH3属于非电解质,Cl2既不是电解质也不是非电解质;B项,只有自发进行的氧化还原反应才能设计成原电池,输出电能;C项,对于放热反应,降低温度平衡向正反应方向移动,平衡常数变大,反应速率减小,反应物的转化率增大;D项,电解饱和食盐水的过程中。水中的H+放电,促进了水的电离。
点拨:本题考查化学概念及化学理论,考查考生分析问题、解决问题的能力。难度中等。
本题难度:一般
3、填空题 某可溶性盐化学式为XY(其中X+为阳离子;Y―为阴离子),将一定量的该盐溶于足量的水中。
(1)若测得溶液的pH为3,则该盐溶液中离子浓度大小关系为:___________ ;
(2)若测得溶液的pH为11,则该盐与水反应的离子方程式为:_____________ ;
(3)若测得溶液的pH为13,则取0.1mol/L的HY溶液100mL中和等浓度的NaOH溶液至中性,所需 NaOH溶液的体积_____________100mL(填“>”、“<”、或“=”)。
参考答案:(1) c(Y-)>c(X+)>c(H+)>c(OH-)
(2) Y-+H2O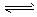 HY+OH-
HY+OH-
(3)<
本题解析:
本题难度:一般
4、填空题 (14分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
| 物质鉴定实验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为________,C、D、E中含有的阳离子为________ |
| ②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 | A为________,C含有的阳离子为________ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为________ |
参考答案:(每空2分,14分)
(1)①CO32-、OH- H+、Al3+、Ag+
②Na2CO3 H+
③AgNO3
(2)2Al3++3SO42-+3Ba2++8OH-===2AlO2-+4H2O+3BaSO4↓
(3)0.01 mol
本题解析:略
本题难度:一般
5、选择题 下列各组物质间能发生离子反应的是(?)
A.食盐和氢氧化钡溶液
B.消石灰和纯碱溶液
C.盐酸与硝酸钠溶液
D.硫酸钠与氯化钾溶液
参考答案:B
本题解析:首先分析反应物在水溶液中的存在哪些离子,然后依据离子反应的条件(有难电离物(如水)、难溶物、易挥发物生成)判断是否发生离子反应。A项中食盐和氢氧化钡溶液存在Na+、Cl-、Ba2+、OH-,C项中盐酸与硝酸钠溶液存在H+、Cl-、Na+、NO3-,D项中硫酸钠与氯化钾溶液存在Na+、SO42-、K+、Cl-,每项中的四种离子不会产生水、难溶物、易挥发物,故A、C、D项中各物质间不能发生离子反应。而B项中消石灰和纯碱溶液存在Ca2+、OH-、Na+、CO32-,其中Ca2+和CO32-能发生反应生成难溶物CaCO3沉淀,故B项可以发生离子反应。
本题难度:简单