时间:2021-02-18 04:53:58
1、填空题 (12分)分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示)?。
②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为?,
c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=_____________,该温度下XnYm的溶解度S=____________g
参考答案:(12分,每空2分)
(1)①Bn-+H2O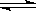 ?HB(n-1)-+OH-?②c(Na+)>c(B-)>c(OH-)>c(H+)、10-10?③11
?HB(n-1)-+OH-?②c(Na+)>c(B-)>c(OH-)>c(H+)、10-10?③11
(2)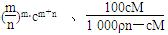
本题解析:略
本题难度:一般
2、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0. 1 mol·L-1AgNO3溶液:H+、K+、SO42- 、I-
D.0. 1 mol·L-1NaAlO2溶液: H+、Na+、Cl-、SO42-
参考答案:A
本题解析:B中显碱性,Cu2+、HCO3-不能大量共存;C中能生成AgI沉淀;D中AlO2-不能在酸性溶液中大量共存;答案选A。
本题难度:一般
3、选择题 下列各种情况下,溶液中可能大量存在的离子组是
[ ? ]
A.澄清透明的溶液中:I-、Cl-、ClO-、Na+
B.常温下,由水电离出的c(H+)=1×10-12 mol/L的溶液中:K+、Ba2+、OH-、NO3-
C.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
D.含有大量Fe2+的溶液中:K+、Na+、SO32-、SO42-
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列各组离子在指定溶液中可能大量共存的是 ( )
①kw/c(H+)=10-3的溶液中:NH4+、Na+、SO42—、C17H35COO
参考答案:
本题解析:
本题难度:困难
5、选择题 常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)<c(CH3COO-)
C.氢氧化钠和醋酸和浓度不相等
D.混合后的溶液呈中性
参考答案:A
本题解析:恰好中和,说明c(CH3CCOH)=0.01mol/L,又知c(H+)=10-4mol/L,所以醋酸的电离度为10-4/0.01=0.01,即1%,A正确;混合后生成CH3COONa发生水解,c(CH3COO-)<c(Na+),B错;因等体积且恰好中和,所以两者的浓度肯定相等,C错;混合后生成强碱弱酸盐,显碱性,D错;答案选A。
本题难度:一般