时间:2021-02-18 04:48:26
1、选择题 下列离子方程式书写正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 ↓+ 2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- = NH3 ↑+ H2O
C.次氯酸钙溶液中通入少量二氧化碳:2ClO- + CO2 + H2O =" 2HClO" + CO32-
D.FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
参考答案:A
本题解析:略
本题难度:一般
2、选择题 能正确表示下列反应的离子方程式是
A.钠与水反应:Na+2H2O=Na++OH-+H2↑
B.Kl溶液中滴入稀硫酸,空气中振荡:4H+ +41-+O2=2I2+2H2O
C.CuCl2溶液中加入氨水:Cu2+ +20H- = Cu(OH)2:↓
D.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-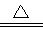 NH3↑+H2O
NH3↑+H2O
参考答案:B
本题解析:A、元素不守恒,错误;B、KI被氧气氧化生成单质碘和水,符合离子方程式的书写,正确;C、一水合氨是弱碱,不能写成离子形式,错误;D、碳酸氢根离子也与氢氧化钠反应,漏掉了离子反应,错误,答案选B。
考点:考查离子方程式的书写
本题难度:一般
3、填空题 (10分)写出下列反应的离子方程式
(1)过氧化钠与水 ;
(2)金属铝与稀硫酸溶液 ;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液 ;
(4)Al和Na的单质同时加入到一定量的水中,充分反应后,发现既无沉淀生成又无固体残留物存在,请用两个离子方程式表示有关生成H2的变化:
(A) ,
(B) 。
参考答案:(10分)(1)过氧化钠与水 2Na2O2 +2H2O==4Na++4OH-+O2↑ ;
(2)金属铝与稀硫酸溶液 2Al+6 H+="=2" Al3+ + 3H2↑ ;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液 Ca2++CO32-==CaCO3↓
(4)(A) 2Na+2H2O==2Na++2OH-+H2↑ ,
(B) 2Al+2O H-+2H2O ="=2" AlO2- + 3H2↑
本题解析:
(1)过氧化钠与水,Na2O2不拆开,写化学式 2Na2O2 +2H2O==4Na++4OH-+O2↑ ;
(2)金属铝与稀硫酸溶液,生成+3价的Al3+ 2Al+6 H+="=2" Al3+ + 3H2↑ ;
(3)向Na2CO3与NaHCO3混和溶液加入CaCl2溶液,只有Na2CO3反应, Ca2++CO32-==CaCO3↓
(4)钠与水反应生成碱,铝有两性,也能溶于强碱
(A) 2Na+2H2O==2Na++2OH-+H2↑ ,
(B) 2Al+2O H-+2H2O ="=2" AlO2- + 3H2↑
本题难度:简单
4、填空题 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
参考答案:
(1)2.2×10-8mol/L( 未写单位不得分) (2)a>c>d>b
(2)①5S2O32-+2Mn2++8H2O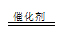 10SO42-+2MnO4-+16H+ (没写反应条件给分)
10SO42-+2MnO4-+16H+ (没写反应条件给分)
②淀粉 94.5%
本题解析:(1)Ksp(BaSO4)=1.1×10-10,当溶液的pH=2时,c(SO42-) ="0.005" mol/L ,c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=2.2×10-8mol/L ;
(2)等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 ,c.(NH4)2SO4 ,d.(NH4)2SO3 中NH4+浓度大于b.NH4HSO4 ,a.Fe2+和NH4+水解相互抑制,d. NH4+和SO32-水解相互促进。所以c(NH4+)由大到小的顺序为a>c>d>b;
(3)过二硫酸钾(K2S2O8)常做强氧化剂,①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,Mn2+被氧化成MnO4-,S2O82-被还原,5S2O32-+2Mn2++8H2O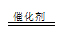 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100
10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100
本题难度:困难
5、选择题 下列反应 的离子方程式中,正确的是 ( )
A.向硝酸银溶液中加盐酸:Ag++C1-=AgCl↓
B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
C.盐酸跟氢氧化镁反应:H++OH-=H2O
D.碳酸钠跟硫酸反应:Na2CO3+2H+=2Na++H2O+CO2↑
参考答案:A
本题解析:略
本题难度:简单