时间:2021-02-18 04:47:44
1、选择题 下列物质中,属于电解质的是
A.铜丝
B.MgCl2 固体
C.NaCl溶液
D.酒精(C2H5OH)
参考答案:B
本题解析:试题分析:A.铜丝是单质,不属于电解质,错误;B.MgCl2 固体属于盐,属于电解质,正确;C.食盐水是混合物,不属于电解质,错误; D.酒精是有机物,属于非电解质,错误。
考点:电解质与非电解质
本题难度:困难
2、选择题 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度关系叙述正确的是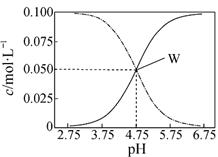
A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.pH=3.5溶液中:c(Na+)+c(H+)-c(O H-)+c(CH3COOH)=0.1mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):
参考答案:C
本题解析:试题分析:pH=5.5比4.75大,从曲线来看CH3COOH的电离在增大,CH3COO-的水解在减小,不可能出c(CH3COOH)>c(CH3COO-),A不正确;根据电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),B不正确;pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol·L-1代入即可,C正确;向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡。溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1mol·L-1,所以不可能得出上述结论,D不正确,答案选C。
考点:考查水解平衡、电离平衡以及溶液中离子浓度大小比较
点评:该题是高考中的常见考点,试题综合性强,所以中等难度的试题。该题属于基本概念与理论的考查,落点在水解与电离平衡、物料守恒和电荷守恒、离子浓度大小比较。溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,在平时学习和训练中要反复加强训练,注意总结和积累。
本题难度:一般
3、填空题 按要求写离子方程式,并回答有关问题。
(1)氢硫酸的电离:___________,溶液中c(H+)、c(HS-)、c(S2-)的大小关系__________。
(2)碳酸钠的水解:___________。
(3)某学生做如下实验,将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热,观察到此溶液的浅红色加深,若冷却至室温时则又变回原来的颜色,为什么?(用方程式说明) 答:_____________________________。
参考答案:(1)H2S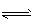 H++HS-,HS-
H++HS-,HS-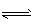 H++S2-;c(H+)>c(HS-)>c(S2-)
H++S2-;c(H+)>c(HS-)>c(S2-)
(2)CO32-+H2O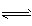 HCO3-+OH-, HCO3-+H2O
HCO3-+OH-, HCO3-+H2O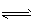 H2CO3+OH-,
H2CO3+OH-,
(3)HCO3-+H2O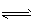 H2CO3+OH-,溶液显碱性;因为水解吸热,加热时水解平衡向右移动c(OH-)增大,溶液的浅红色加深,冷却时,水解平衡向左移动,c(OH-)减小,溶液又回到原来的颜色
H2CO3+OH-,溶液显碱性;因为水解吸热,加热时水解平衡向右移动c(OH-)增大,溶液的浅红色加深,冷却时,水解平衡向左移动,c(OH-)减小,溶液又回到原来的颜色
本题解析:
本题难度:一般
4、选择题 NH4Cl溶液中,下列叙述错误的是( )
A.c(NH4+)>c(Cl-)>c(OH-)>c(?H+)
B.c(Cl-)>c(NH4+)>c(?H+)>c(OH-)
C.c(NH4+)+c(?H+)=c(Cl-)+c(OH-)
D.c(NH4+)+c(?NH3?H2O)=c(Cl-)
参考答案:A、溶液中铵根离子水解,溶液呈酸性.故溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c( H+)>c(OH-),故A错误;
B、溶液中铵根离子水解,溶液呈酸性,故溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c( H+)>c(OH-),故B正确;
C、溶液中存在电荷守恒,阴阳离子所带电荷数相同,溶液中的电荷守恒为:c(NH4+)+c( H+)=c(Cl-)+c(OH-);故C正确;
D、依据溶液中物料守恒,氮元素守恒得到:c(NH4+)+c( NH3?H2O)=c(Cl-),故D正确;
故选A.
本题解析:
本题难度:简单
5、选择题 下列属于电解质的是
A.蔗糖
B.盐酸
C.酒精
D.氢氧化钠
参考答案:D
本题解析:在水溶液中或熔融状态下可导电的化合物属于电解质,而盐酸为溶液,是混合物,排除;蔗糖、酒精为不能导电的有机物,排除,故答案为D
本题难度:一般