时间:2021-02-18 04:41:29
1、填空题 原子序数为13的元素位于元素周期表中第______周期、______族,其原子结构示意图为______.
参考答案:原子序数为13的元素,质子数为13,核外电子数为13,有3个电子层,最外层有3个电子,位于周期表中第三周期第ⅢA族;原子结构示意图为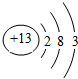
.
故答案为:三;ⅢA;
.
本题解析:
本题难度:一般
2、选择题 某元素原子最外层上只有2个电子,该元素一定是
[? ]
A.金属元素
B.ⅡA族元素
C.稀有气体元素
D.无法确定
参考答案:D
本题解析:
本题难度:简单
3、选择题 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
A.Z元素形成的某种氧化物能使品红溶液褪色
B.X和Z的最高价氧化物对应的水化物都是弱酸
C.X与Y元素形成的化合物的相对分子质量是100g?mol-1
D.Y元素形成的单质能在氧气中燃烧但不能在二氧化碳中燃烧
参考答案:Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的3倍,说明Z原子最外层6个电子,Y原子最外层2个电子,又X与Y、Z位于相邻周期,三原子的最外层电子数之和为13,可以推知X、Y、Z分别是N、Mg、S,则
A.Z元素形成的氧化物有SO2、SO3等氧化物,其中SO2具有漂白性,能使品红褪色,故A正确;
B.X和Z的最高价氧化物对应的水化物硝酸和硫酸,都是强酸,故B错误;
C.X与Y元素形成的化合物为Mg3N2,相对分子质量为100,故C错误;
D.Mg可在CO2中燃烧生成MgO和C,故D错误.
故选A.
本题解析:
本题难度:简单
4、简答题 A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M.1molM中含有42mol电子.回答下列问题:
(1)E元素在周期表中的位置:______周期______族;化合物M中含有的化学键类型有______;用电子式表示化合物A2C的形成过程:______
(2)比较B、C、E形成的气态氢化物的稳定性(用化学式表示):______>______>______;写出C与A形成的18e-化合物的电子式______;
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:______;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原电池反应,则负极上的电极反应式为______.
参考答案:E的单质可做半导体材料,应为Si元素,B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,则B应为非金属元素,只有N元素符合,形成的化合物为NH4NO3,1mol中含有42mol电子,B、D、E三种元素原子的最外层电子数之和为10,则D的最外层电子数为10-4-5=1,又D的原子序数最大,应为Na元素,A、D同主族,且A的原子序数和原子半径都最小,应为H元素,根据C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应,应是
SiO2和NaOH的反应,则C为O元素,
(1)由以上分析可知E为Si元素,原子序数为14,原子核外有3个电子层,最外层电子数为4,则应位于周期表第三周期第ⅣA族;M为NH4NO3,为离子化合物,含有离子键和极性共价键;A2C为H2O,为共价化合物,可用电子式表示其形成过程为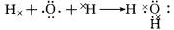
.
故答案为:第三周期、第ⅣA族;离子键和极性共价键;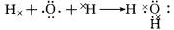
.
(2)B、C、E形成的气态氢化物分别为NH3、H2O、SiH4,由于非金属性O>N>Si,则氢化物稳定性为H2O>NH3>SiH4,C与A形成的化合物中,H2O2含有18个e-,其电子式为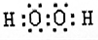
.
故答案为:H2O>NH3>SiH4;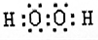
.
(3)SiO2为酸性氧化物,与NaOH反应生成硅酸钠和水,反应的离子方程式为SiO2+2OH-=SiO32-+H2O.
故答案为:SiO2+2OH-=SiO32-+H2O.
(4)碱性氢氧电池中,负极通入氢气,发生氧化反应,电极反应式为H2+2OH--2e-=2H2O.
故答案为:H2+2OH--2e-=2H2O.
本题解析:
本题难度:一般
5、简答题 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
请回答下列问题(填空时用实际符号):
(1)C的元素符号是______;元素F在周期表中的位置______.
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物?B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为______,其固体时的晶体类型是______.
(3)最近意大利罗马大学的FuNvio?Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量.根据以上信息和数据,下列说法正确的是______.
①C4属于一种新型的化合物
②C4沸点比P4(白磷)低
③lmol?C4气体转变为C2吸收882kJ热量
④C4与C2互为同素异形体
⑤C4稳定性比P4(白磷)差
⑥C4属于原子晶体
⑦C4和P4?(白磷)的晶体都属于分子晶体
⑧C4与C2互为同分异构体
(4)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为______,其空间构型为______.
(5)为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:______
(6)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似.对此以下说法正确的是______.
a.E2F2的结构式为:F-E-E-F
b.E2F2为含有极性键?和非极性键的非极性分子
c.E2Br2与E2F2结构相似,熔沸点:E2Br2>E2F2
d.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+3E↓+4HF
(7)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):______.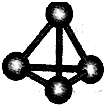
参考答案:A、B、C、D、E、F六种短周期元素,原子序数依次增大,D与E的氢化物分子构型都是V型,则氢化物为H2O、H2S,则D为氧元素,E为硫元素;原子序数F大于硫元素,故F为氯元素;A与D可形成的化合物,常温下均为液态,则A为氢元素;A能分别与B、C、D形成电子总数相等的分子,B为碳元素,C为氮元素,可形成10电子分子,满足A、B的最外层电子数之和与C的最外层电子数相等,符合题意.
故A为氢元素;B为碳元素,C为氮元素,D为氧元素,E为硫元素;F为氯元素.
(1)由上述分析可知,C为N;F为氯元素,原子核外有17 个电子,有3个电子层,最外层有7个电子,位于周期表第3周期第ⅦA族.
故答案为:N;第3周期第ⅦA族.
(2)B为碳元素,D为氧元素,直线型气态化合物?B2D2分子为C2O2,且各原子最外层都满足8电子结构,分子中碳原子与碳原子之间形成2对共用电子对,每个碳原子与1个氧原子形成2对共用电子对,则C2O2电子式为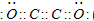
,其固体时的晶体类型是分子晶体.
故答案为: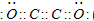
;分子晶体.
(3)①N4只含一种元素,属于单质,故①错误;
②N4与P4(白磷)都形成分子晶体,P4相对分子质量大,分子间作用力强,P4沸点高,故②正确;
③lmol?N4气体转变为N2,断开化学键吸收能量为167kJ×4=668kJ,形成化学键放出能量为942kJ×2=1884kJ,所以反应放出能量为1884kJ-668kJ=1276kJ,故③错误;
④N4与N2都是氮元素组成的结构不同的单质,互为同素异形体,故④正确;
⑤P4(白磷)易自然,稳定性差,故⑤错误;
⑥N4属于分子晶体,故⑥错误;
⑦N4和P4?(白磷)的晶体都属于分子晶体,故⑦正确;
⑧同分异构体研究对象为化合物,N4与N2互为同素异形体,故⑧错误.
故选:②④⑦.
(4)C为氮元素,F为氯元素两种元素形成一种化合物分子,各原子最外层达8电子结构,分子中存在3个N-Cl键,
则该分子的结构式为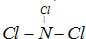
,与氨气结构类似,其空间构型为三角锥型.
故答案为: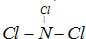
;三角锥型.
(5)A2ED3为H2SO3,A2D2是H2O2,H2O2将亚硫酸氧化为硫酸,反应离子方程式为H2O2+H2SO3=2H++SO42-+H2O.
故答案为:H2O2+H2SO3=2H++SO42-+H2O.
(6)E与F形成的化合物E2F2为S2Cl2,遇水易水解,其空间结构与H2O2极为相似.
a.S2Cl2的空间结构与H2O2极为相似,所以结构式为:Cl-S-S-Cl,故a正确;
b.H2O2为打开的书页形结构,-O-H处于两个平面,是极性分子,S2Cl2的空间结构与H2O2极为相似,为含有极性键和非极性键的极性分子,故b错误;
c.E2Br2与E2F2结构相似,都能形成分子晶体,相对分子质量越大熔沸点越高,所以熔沸点:E2Br2>E2F2,故c正确;
d.S2Cl2遇水解,反应2S2Cl2+2H2O=SO2↑+3S↓+4HF,符合氧化还原反应,且电子转移相等,可能发生该反应,故d正确.
故选:acd.
(7)元素的非金属性越强,单质的氧化性越强,氧化剂氧化性强于氧化产物氧化性,所以反应C12+H2S=S↓+2HCl,可以说明Cl的非金属性比S强.
故答案为:C12+H2S=S↓+2HCl.
本题解析:
本题难度:一般