时间:2021-02-18 04:41:29
1、选择题 日本9级大地震导致的福岛核泄漏,主要泄露的物质为碘131,碘131一旦被人体吸入会引发甲状腺疾病,引发低甲状腺素(简称低甲)症状,患者必须长期服用甲状腺素片,而更严重的甚至可能引发甲状腺癌变.下列说法中不正确的是( )
A.131I和127I互为同位素
B.碘处于第五周期ⅦA族
C.干燥的氯气接触淀粉KI试纸,试纸变蓝
D.碘的CCl4溶液呈红色
2、选择题 X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是?
[? ]
A.由mXa+与nYb-得,m+a=n-b?
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
3、选择题 X、Y、Z、W四种短周期元素的最外层电子数之和为20.在周期表中X与Y、Z、W紧密相邻,X、Y两元素的原子序数之和等于Z元素的原子序数.下列说法正确的是( )
A.原子序数:Z>Y>X>W
B.X、Y、Z、W形成的单质最多有6种
C.X元素最高价氧化物对应水化物的化学式为:H3XO4
D.四种元素的气态氢化物中,W的气态氢化物最稳定
4、选择题 短周期元素W、X、Y和Z的原子序数依次增大。W原子形成的单质是密度最小的气体,X原子的最外层电子数是内层电子数的2倍,Y原子的最外层电子数是其电子层数的3倍,元素Z是地壳中含量最多的金属元素。下列说法不正确的是
[? ]
A.元素X与W形成的原子个数比为1:1的化合物有多种
B.Y与Z的简单离子的半径大小是Yn-<Zm+
C.元素Z的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Y可与元素X形成直线型化合物XY2
5、简答题 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
(1)W在元素周期表中的位置是______,Z2Y的电子式是______.
(2)①已知“凡气体分子总数增多的反应一定是熵增大的反应”.根据所学知识判断如下反应2WY(g)=2W(s)+Y2(g)△H>0,在常温下______自发进行(填“能”或“不能”).
②400℃时,在0.5L的反应容器中用X2、Q2反应合成XQ3反应,达到平衡时,测得X2、Q2、XQ3的物质的量分别为2mol、1mol、2mol,则此反应在400℃时的化学平衡常数为______
(3)2.24L(标准状况)XQ3被200mL?1mol/L?QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是______.
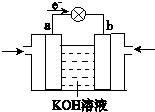
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是______
(5)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是______.