时间:2021-02-18 04:40:27
1、选择题 下列含有共价键的离子化合物是( )
A.NH4Cl
B.H2O
C.N2
D.MgCl2
参考答案:A.氯化铵中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键,为离子化合物,故A正确;
B.水分子中氢原子和氧原子之间只存在共价键,为共价化合物,故B错误;
C.氮气分子中氮原子之间只存在共价键,为单质,故C错误;
D.氯化镁中镁离子和氯离子之间中存在离子键,为离子化合物,故D错误;
故选A.
本题解析:
本题难度:简单
2、选择题 下列过程中化学键未被破坏的是( )
A.干冰升华
B.溴与H2生成HBr
C.SO2气体溶于水
D.NaCl固体溶于水
参考答案:A、干冰升华,只是状态的变化,干冰的构成微粒是分子,气态的二氧化碳构成微粒也是分子,所以化学键未被破坏,故A正确;
B、溴和氢气生成溴化氢,发生了化学反应,有化学键的破坏,故B错误;
C、二氧化硫溶于水,二氧化硫和水发生化学反应生成亚硫酸,所以有化学键的破坏,故C错误;
D、氯化钠固体溶于水,氯化钠在水分子的作用下电离出自由移动的阴阳离子,所以化学键被破坏,故D错误;
故选A.
本题解析:
本题难度:一般
3、填空题 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ): 根据上述数据回答(1)~(6)题。

参考答案:(1)A
(2)A
(3)放热
(4)Cl2
(5)能 ;生成物越稳定,放出的热量越多,在HX中,HCl最稳定
(6)H2(g)+ Cl2(g)=2HCl(g) △H=-185 kJ·mol-1
本题解析:
本题难度:一般
4、填空题 (共18分)I(6分)写出下列热化学反应方程式
(1)N2 (g)与H2(g)反应生成1molNH3(g),放出46.1KJ热量。
(2)1molC2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8KJ热量。
(3)1molC(石墨)与适量H2O(g)反应吸收131.3KJ热量
II.(12分)(1)化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因。生成物中化学键形成时会__________能量(填“放出”或“吸收”);如果一个化学反应,化学键断裂时的能量变化大于化学键形成时的能量变化,则该反应属于_________反应; 如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。
如果一个化学反应,反应物的总能量和生成物的总能量有如图所示的关系,则该反应属于__________反应。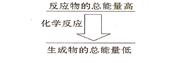
(2)不同形式的能量可以相互转换,如:化学能和电能、热能之间的相互转换。如图是一个原电池工作原理的示意图。试回答: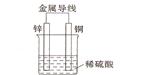
①从能量角度看,它属于____________能转化为____________能;
②装置中Zn为____________极。
参考答案:(18分)I(1)1/2N2(g)+3/2H2(g)=NH3(g) △H=-46.1 kJ·mol-1
(2)C2H5OH(g)+3O2(g)==2CO2(g)+3H2O(l);△H=-1366.8 kJ·mol-1
(3)C(石墨s)+H2O(g)="=" CO(g)+ H2(g);△H=131.3 kJ·mol-1(每空2分)
II(1)放出 吸热 放热 (2)①化学 电 ②负 (每空2分)
本题解析:略
本题难度:一般
5、选择题 已知中和热的数值是57.3 kJ·mol
参考答案:
本题解析:
本题难度:简单