时间:2021-02-18 04:37:36
1、选择题 下列反应的离子方程式正确的是
A.用铁丝网作电极,电解饱和食盐水:2C1—+2H2OH2↑+C12↑+2OH—
B.Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:
3Ba2++6OH—+2Al3++3SO42—3BaSO4↓+2Al(OH)3↓
C.将过量的CO2通入Ca(C1O)2溶液中:2C1O—+CO2+H2O2HC1O+CO32—
D.向Mg(HCO3)2溶液中加入过量的澄清石灰水:
Mg2++2HCO3—+2OH一+Ca2+?MgCO3+CaCO3↓+2H2O
参考答案:B
本题解析:A:铁作电极,阳极上铁会失电子,故电解方程式为:Fe+2H2O=Fe(OH)2+H2↑
B:Ba(OH)2不足,其离子个数比为1:2,正确
C:由于CO2过量,故产物为碳酸氢盐:C1O—+CO2+H2O?HC1O+HCO3—
D:MgCO3溶解度较大,应得到溶解度更小的Mg(OH)2:
Mg2++2HCO3—+4OH一+2Ca2+?Mg(OH)2↓+2CaCO3↓+2H2O
本题难度:一般
2、选择题 化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是
[? ]
A.用食醋除去水壶内的水垢:CaCO3+2H+?=?Ca2++CO2↑+H2O
B.纯碱溶液呈碱性的原因是:CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
C.?钢铁发生吸氧腐蚀的正极反应式:O2+?4e-?+2H2O?=4OH-
D.表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)=?2H2O(l);△H?=?-571.6?KJ·mol-1
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列离子方程式的书写正确的是
A.实验室用大理石和稀盐酸制取CO2 : 2H++CO32-=CO2↑+H20
B.铁和稀盐酸反应:Fe+2H+=Fe2++H2↑
C.氢氧化钡溶液中加入足量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.钠投入水中:Na+H20= Na++OH-+H2↑
参考答案:B
本题解析:A错误,大理石碳酸钙是难溶物,在书写离子方程时不能拆成离子形式。
B正确。
C错误,氢氧化钡溶液中加入足量稀硫酸正确的是:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D错误,元素不守恒。
本题难度:简单
4、选择题 下列离子方程式书写正确的是( )
A.在氯化铝溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓
B.将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
C.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-
参考答案:A.在氯化铝溶液中加入过量的NaOH溶液的离子反应为Al3++4OH-=AlO2-+2H2O,故A错误;
B.将少量SO2气体通入NaClO溶液中的离子反应为SO2+ClO-+H2O=SO42-+2H++Cl-,故B错误;
C.NH4HCO3溶液与过量NaOH溶液反应的离子反应为HCO3-+NH4++2OH-=2NH3↑+2H2O+CO32-,故C错误;
D.FeCl2溶液中通入Cl2的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是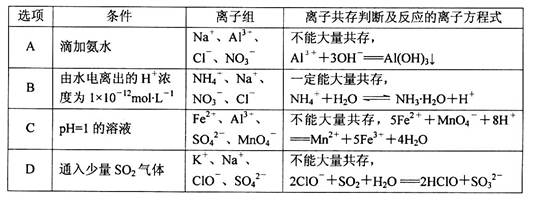
参考答案:C
本题解析:A、铝离子和氨水发生反应:Al3+ + 3NH3·H2O====Al(OH)3↓+ 3NH4+,不能大量共存,错误;B、由水电离出的H+浓度为1×10—12mol·L—1的溶液既可能显酸性,又可能显碱性,碱性条件下,氢氧根和铵离子反应生成弱电解质一水合氨,不能大量共存,错误;C、pH=1的溶液中,氢离子、亚铁离子和高锰酸根发生氧化还原反应,不能大量共存,正确;D、ClO-具有强氧化性,可将SO2氧化为硫酸根,错误。
本题难度:一般