时间:2021-02-18 04:32:53
1、选择题 常温下某溶液中,水电离出的C(OH-)=10-4mol/L,该溶液中的溶质可能是 ( )
A.硫酸铝
B.醋酸钠
C.氢氧化钠
D.硫酸氢钠
参考答案:B
本题解析:常温下由水电离出的C(OH-)=10-4mol/L,说明所加的溶质促进水的电离,结合选项知,只能是水解呈碱性的强碱弱酸盐醋酸钠。
本题难度:一般
2、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:
c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32?)+2c(H2CO3)
C.0.1 mol·L-1 NH4Cl溶液:c(NH4+)="c(" Cl-)
D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:AB
本题解析:由已知条件可知,c(HCl)<c(NH3?H2O),则氨水过量,混合后溶液呈弱碱性,则c(OH-)>c(H+),由电荷守恒原理可知c(NH4+)>c(Cl-),故A项错误;符合物料守恒原理,故B项正确;NH4Cl= NH4++ Cl-,弱碱阳离子部分水解,则c(NH4+)<c( Cl-),故C项错误;违反电荷守恒原理,应为c(CH3COO-)> c(Na+)>c(H+)>c(OH-),故D项错误。
本题难度:一般
3、选择题 相同物质的量浓度的下列物质的稀溶液中,pH最大的是(?)?
A.乙醇
B.乙酸钠
C.苯酚钠
D.碳酸钠
参考答案:D
本题解析:略
本题难度:简单
4、选择题 向氨水中逐滴加入稀盐酸,使溶液呈中性,则此时()
A.c( )=c(Cl-)
)=c(Cl-)
B.c( )>c(Cl-)
)>c(Cl-)
C.c( )<c(Cl-)
)<c(Cl-)
D.c( )与c(Cl-)关系不定
)与c(Cl-)关系不定
参考答案:A
本题解析:经分析知道,此溶液中含有 、H+、OH-、Cl-四种离子。据电荷守恒有:c(
、H+、OH-、Cl-四种离子。据电荷守恒有:c( )+c(H+)=c(OH-)+c(Cl-),因为溶液显中性,所以有c(H+)=c(OH-),可得c(
)+c(H+)=c(OH-)+c(Cl-),因为溶液显中性,所以有c(H+)=c(OH-),可得c( )=c(Cl-)。所以选A。
)=c(Cl-)。所以选A。
本题难度:简单
5、选择题 将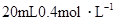 硝酸铵溶液跟
硝酸铵溶液跟 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.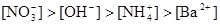
B.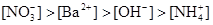
C.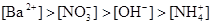
D.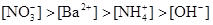
参考答案:B
本题解析:NH4NO3的物质的量为:0.02×0.4=0.008mol,Ba(OH)2的物质的量为:0.05×0.1=0.005mol,OH-为0.01mol。首先两溶液混合要考虑下列反应:NH4++OH-=NH3·H2O,OH-剩余0.002mol。由上述分析可得: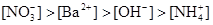 ,答案选B。
,答案选B。
本题难度:一般