时间:2021-02-18 04:31:46
1、选择题 下列关于化学反应速率的说法正确的是(? )
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.化学反应速率为0.8mol/(L·s)是指1s时某物质的浓度为0.8mol/L
C.化学反应速率是指一定时间内反应物的物质的量减少或生成物的物质的量增加
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
2、选择题 下列关于化学反应速率和反应限度的说法正确的是( )
A.化学反应速率通常只能用反应物浓度的减少量表示
B.影响化学反应速率的条件并不只是温度和催化剂
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.反应限度是一种平衡状态,此时反应已经停止
3、选择题 反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
A.①v(A)=0.15mol/(L?s)
B.②v(B)=0.6mol/(L?s)
C.③v(C)=0.4mol/(L?s)
D.④v(D)=0.45mol/(L?s)
该反应进行的快慢顺序为 。
4、选择题 ?在2A(g)+B(g)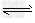 ?3C(g)+4D(g)中,下列情况能够降低该反应速率的是
?3C(g)+4D(g)中,下列情况能够降低该反应速率的是
[? ]
A.?升高温度?
B.?减小压强?
C.?使用催化剂?
D.?增大A的浓度
5、计算题 在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)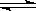 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,试求:
(1)x值
(2)B的平衡浓度
(3)A的转化率
(4)用A表示的化学反应速率