时间:2021-02-18 04:29:36
1、填空题 将下列变化中浓硫酸所表现的性质的编号填入下表的空白处:
①在水溶液中电离,并呈强酸性?
②具有高沸点、难挥发性?
③浓硫酸具有吸水性?
④浓硫酸具有脱水性
?⑤浓硫酸具有强氧化性? ?
⑴铜跟浓硫酸共热,产生二氧化硫气体。 ?
⑵浓硫酸可以干燥H2、SO2等气体。 ?
⑶氯化钠固体跟浓硫酸的混和物共热时产生氯化氢气体。 ?
⑷浓硫酸跟灼热的炭反应时产生混和气体。 ?
⑸纸张、布片、蔗糖等遇浓硫酸会慢慢变黑。 ?
⑹浓硫酸跟磷酸钙反应可生成磷酸。
⑺浓硫酸能用铝、铁槽车贮放 
参考答案:
本题解析:
本题难度:一般
2、选择题 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。关于反应中镁和铝的说法正确的是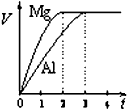
[? ]
A.质量之比为3:2
B.物质的量之比为4:3
C.摩尔质量之比为2:3
D.消耗硫酸的物质的量之比为1:1
参考答案:D
本题解析:
本题难度:一般
3、填空题 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如下所示.实验步骤及现象如下:①先连接如图装置,检查气密性,再加入试剂;②加热试管A,B中品红溶液退色,熄灭酒精灯;③将Cu丝向上抽动使下端离开液面.
(1)步骤(2)中试管A中物质发生反应的化学方程式______.
(2)在盛有BaCl2溶液的试管C中,除了导管口有气泡外,无其他明显现象,将试管中的溶液取出,滴加氯水,产生的现象是______;发生反应的离子方程式为______,______.
(3)试管D中NaOH溶液的作用是______.
(4)试管B中品红溶液退色说明SO2具有漂白性,已知Cl2也能使品红退色.现有两瓶分别经过SO2和Cl2漂白过的品红溶液,请你设计一个简单的实验对其进行鉴别(写明操作方法、现象及结论)______.
参考答案:(1)铜与浓硫酸共热生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)△.CuSO4+SO2↑+2H2O;
(2)氯气能够与二氧化硫发生氧化还原反应生成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,反应的离子方程式为:SO2+H2O+Cl2═2Cl-+4H++SO42-、SO42-+Ba2+=BaSO4↓,所以向试管中滴加氯水,溶液会变浑浊,
故答案为:溶液变浑浊;SO2+H2O+Cl2═2Cl-+4H++SO 91eXaM.org42-;SO42-+Ba2+=BaSO4↓;
(3)二氧化硫有毒,为了防止造成污染,需要使用尾气吸收装置,可以用氢氧化钠溶液吸收多余的二氧化硫,
故答案为:吸收SO2防止污染;
(4)因二氧化硫的漂白为暂时性,结合生成的无色物质不稳定,则实验方案为将褪色后的溶液加热,若重新恢复红色,则通入的气体是SO2;若仍为无色,则通入的气体是Cl2,
故答案为:将褪色后的溶液加热,若重新恢复红色,则通入的气体是SO2;若仍为无色,则通入的气体是Cl2.
本题解析:
本题难度:一般
4、简答题 [化学-化学与技术]硫酸工业生产应考虑综合经济效益问题.
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在______的郊区(填标号);
A.有丰富黄铁矿资源的城市
B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市
D.人口稠密的文化、商业中心城市
(2)CuFeS2是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为______.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是______.
A.黄铁矿燃烧前需要粉碎,因为大块的黄铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应
C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率
D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 炉渣中CuSO4的质量分数/% 9.3 9.2 9.0 8.4 |
参考答案:(1)A.硫酸厂厂址的选择综合经济效益考虑,硫酸产品的运输成本要高于原料黄铁矿的运输成本.故A不正确;
B.风光秀丽的旅游城市,不靠近原料基地,也不靠近消耗硫酸的工业城市,导致原料运输与产品运输成本高,同时还会对旅游城市造成污染.故B不正确;
C.由于硫酸产品的运输成本要高于原料黄铁矿的运输成本,所以厂址应选择在消耗硫酸甚多的工业城市.故C正确;
D.人口稠密的文化、商业中心城市,远离原料基地和消耗硫酸的工业城市,同时为了防止污染环境,不宜考虑作为硫酸厂厂址.故D不正确;
故答案为:C;
(2)根据题意可知,高温煅烧时CuFeS2时,反应物为CuFeS2和O2,生成物为CuO、Fe2O3和SO2,再根据化合价升降法配平氧化还原反应方程式,
故答案为:4CuFeS2+13O2煅烧.4CuO+2Fe2O3+8SO2;
(3)A.在硫酸工业制法中,黄铁矿燃烧前需要粉碎,是为了增大与空气的接触面,加快反应速率,不是因为大块的黄铁矿不能在空气中燃烧.故A不正确;
B.从沸腾炉出来的炉气中含有SO2、O2、N2、水蒸气、灰尘、砷硒化合物等,由于砷硒化合物能导致催化剂失去催化活性,因此需净化,不是因为炉气中二氧化硫会与杂质反应,故B不正确;
C.二氧化硫氧化为三氧化硫时需使用催化剂,目的是加快反应速率,提高产量.并不能提高二氧化硫的转化率,故C不正确;
D.在吸收塔中三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率.故D正确;
故答案为:D;
(4)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),根据题意由表中数据可知,硫酸铜的质量分数随沸腾炉温度升高而降低,是因为反应CuO+SO3△.CuSO4中SO3的质量减少导致的,根据2SO2(g)+O2(g)催化剂
本题解析:
本题难度:一般
5、选择题 浓硫酸和浓盐酸露置在空气中一段时间后,浓度都会降低,主要原因是( )
A.都是因为溶质减少
B.浓硫酸是因为溶质减少,浓盐酸是因为溶剂增多
C.都是因为溶剂增多
D.浓盐酸是因为溶质减少,浓硫酸是因为溶剂增多
参考答案:由于浓盐酸有挥发性,浓硫酸有吸水性,因此它们敞口放置在空气中一段时间后,前者质量变小,由于浓盐酸挥发出氯化氢溶质而导致浓度减小,浓硫酸吸水后溶剂增加,而导致浓度减小.
故选D.
本题解析:
本题难度:一般