时间:2020-08-23 08:24:00
1、填空题 如图是氯化钠的晶胞示意图,回答如下问题
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。 A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25g NaCl晶体,强热使其气化,测的气体体积为5.6L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取ag NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为bcm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
2、选择题 仔细观察下图,它表示的是晶体还是非晶体 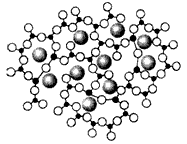
[? ]
A.是晶体
B.可能是晶体,可能是非晶体
C.是非晶体
D.不能确定
3、选择题 下列分子构型为四面体的是
[? ]
①P4②NH3③CCl4④金刚石⑤CH4⑥SiO2⑦H2S⑧CO2
A.①③④⑤
B.①③④⑤⑥
C.①③⑤
D.④⑤
4、填空题 在核电荷数为1—18的元素中,其单质属于金属晶体的有_______,金属中,密度最小的是_______,地壳中含量最多的金属元素是_______,熔点最低的是_______,既能与酸反应又能与碱反应的是_______,单质的还原性最强的是_______。
5、选择题 下列有关金属的说法正确的是
A.金属原子的核外电子在金属晶体中都是自由电子
B.体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.金属导电的实质是金属阳离子在外电场作用下的定向移动