时间:2020-08-23 08:22:35
1、选择题 多硫化钠Na2Sx(x≥2)在NaOH溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的物质的量之比为1:16。Na2Sx在结构上与Na2O2相似。则下列有关说法正确的是
[? ]
A.该反应中Na2Sx是氧化剂,NaClO是还原剂
B.Na2Sx含有离子键和极性共价键
C.1 mol Na2Sx参加反应,有32 mol电子转移
D.Na2Sx中的x数值为2
2、选择题 据新浪科技网报道:美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这很可
能是21世纪人类最伟大的发现之一,将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含元素之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是(?)
A.离子键
B.共价键
C.一种静电引力
D.一种静电斥力
3、选择题 下列物质的电子式书写正确的是
[? ]
A.Na2O 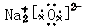
B.H2S 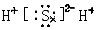
C.H2O2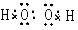
D.N2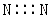
4、选择题 2009年1月18日电,由552名中国科学院院士和中国工程院院士投票评选出的2008年世界十大科技进展新闻揭晓,“铁基超导材料研究获重大进展”名列榜单.由日本和中国科学家相继发现的新的高温超导材料--铁基超导材料:其成分是氟掺杂镧(La)氧铁砷(As)化合物.下列有关该材料的判断正确的是( )
A.在周期表中,该材料所含五种元素有两种位于主族,三种位于副族
B.该超导材料所含五种元素有两种金属元素,三种非金属元素
C.该超导体材料耐酸腐蚀
D.在周期表中,铁位于第VIII族,砷位于第四周期
5、简答题 现有A、B、C、D四种元素,前三种元素的离子结构都和氖原子具有相同的核外电子排布.A没有正价态的化合物;B的氢化物化学式为H2B,0.2mol的C原子能从酸中置换产生2.24LH2(S.T.P.).D的原子核中没有中子.
(1)根据以上条件,计算、推断A、B、C、D的元素名称.
(2)用电子式表示C与A,B与D,C与B(加热条件下),相互结合成的化合物,指出其化学键类型及晶体的类型.