时间:2020-08-23 08:22:35
1、选择题 电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是
①CO和CO2 ②NO和NO2 ③CH4和NH3?④ CO和N2?⑤CO2和SO2?⑥CO2和N2O
A.1组
B.2组
C.3组
D.4组
参考答案:C
本题解析:六组都是共价化合物,没有电子的得失,所以微粒的电子数等于原子电子数之和,如CO的电子数为6+8=14,而CO2的电子数为6+2×8=22.电子数相等的有?④⑥三组,故选C
点评:考查微粒电子数的计算,注意区分共价化合物和离子化合物的计算
本题难度:一般
2、选择题 下列物质中,既有离子键,又有共价键的是
[? ]
A.MgCl2
B.KOH
C.NH3
D.H2O2
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列化学用语错误的为( )
A.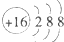
B.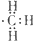
C.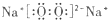
D.
参考答案:A.表示硫离子的结构示意图,故A正确;
B.甲基是电中性基团,碳原子与氢原子之间形成对共用电子对,碳原子含有1个单电子,甲基电子式为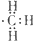 ,故B正确;
,故B正确;
C.过氧化钠属于离子化合物,由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成1对共用电子对,电子式为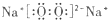 ,故C正确;
,故C正确;
D.氮气分子中氮原子之间形成3对共用电子对,氮原子含有1对孤对电子对,电子式为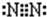 ,故D错误;
,故D错误;
故选D.
本题解析:
本题难度:简单
4、选择题 下列说法错误的是(?)
A.附着在试管内壁上的AgCl固体可用氨水溶解而洗去
B.可用氨水鉴别AlCl3、AgNO3和CuSO4三种溶液
C.向氨水中滴加CuSO4溶液至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液
D.加热碘单质,产生紫色碘蒸气,这个过程只克服范德华作用力
参考答案:C
本题解析:氯化银能溶于氨水形成配合物,A正确。氨气能和银离子、铜离子形成配合物,但氨水不能溶解氢氧化铝,所以B正确。C不正确,应该是向硫酸铜溶液中滴加氨水至过量,先产生蓝色沉淀,然后沉淀溶解并得到深蓝色溶液。碘属于分子晶体,升华破坏的是分子间作用力,D正确。所以答案选C。
本题难度:一般
5、选择题 下列排列顺序正确的是( )
A.固体的热稳定性:Na2CO3>CaCO3>NaHCO3
B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+
C.电离出氢离子的能力:CH3COOH>C2H5OH>H2O
D.氢化物的沸点:H2Se>H2S>H2O
参考答案:A
本题解析:略
本题难度:一般