时间:2020-08-23 08:19:06
1、选择题 对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)= 3v(Z)
B.2v(X)= 3v(Z)
C.2v(X)= v(Y)
D.3v(W)= 2v(X)
2、填空题 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为 (标准状况),被氧化的HCl的物质的量是 。
3、填空题 (8分)水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)写出水分子的结构式 。
(2)全部由短周期元素组成的A、B、C三种物质,是中学化学常见的有色物质,它们均能与水发生氧化还原反应,但反应中水既不作氧化剂也不作还原剂。请写出A、B、C与水反应的化学方程式:
①A十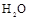 __________________ _______ __;
__________________ _______ __;
②B十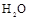 ;
;
③C十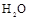 。
。
4、选择题 只有加入还原剂才能发生转化的是
A.KMnO4→MnO2
B.HNO3→NO
C.Cl2→Cl-
D.SO2→Na2SO3
5、选择题 实现下列转化,必须加入氧化剂或还原剂的是
A.Cl2→HClO+HCl
B.NH4+→NH3
C.NH3→NO
D.P2O5→H3PO4