时间:2020-08-23 08:10:49
1、填空题 常温下,有浓度均为0.1?mol/L的4种溶液:①盐酸;②硫酸;③醋酸;④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号)_______。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是_______。
参考答案:(1)②和④
(2)c(OH-)>c(Ba2+)>c(CH3COO-)>c(H+)
本题解析:
本题难度:一般
2、选择题 下列离子方程式正确的是
A.硫化钠的水解反应:HS-+H2O?H3O++S2-
B.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
C.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.用铜为电极电解稀硫酸溶液:2H2O?2H2↑+O2↑
参考答案:B
本题解析:分析:A.水解生成HS-;
B.发生氧化还原反应生成硝酸铁、NO、水;
C.反应生成碳酸钙、碳酸钠、水;
D.Cu失去电子,水中的氢离子得电子.
解答:A.硫化钠的水解反应的离子反应为HS-+H2O?OH-+HS-,故A错误;
B.在氯化亚铁溶液中加入稀硝酸的离子反应为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,故B正确;
C.向Ca(HCO3)2溶液中加入足量的氢氧化钠溶液的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-,故C错误;
D.用铜为电极电解稀硫酸溶液的离子反应为Cu+2H2O? ?H2↑+Cu(OH)2↓,故D错误;
?H2↑+Cu(OH)2↓,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,明确离子反应的实质、离子反应中保留化学式的物质是解答本题的关键,注意B中的氧化还原反应为解答的易错点,题目难度不大.
本题难度:简单
3、选择题 下列叙述正确的是
[? ]
A.非金属氧化物一定是酸性氧化物,碱性氧化物一定是金属氧化物
B.由不同原子组成的纯净物一定是化合物
C.氢氧化铁胶体稳定存在的主要原因是胶粒带电,向其中滴加少量稀硫酸,将有沉淀产生,继续滴加,沉淀溶解
D.离子化合物均属于强电解质,都易溶于水
参考答案:C
本题解析:
本题难度:简单
4、选择题 常用图像直观地描述化学反应的进程或结果。下列有关图像的描述正确的是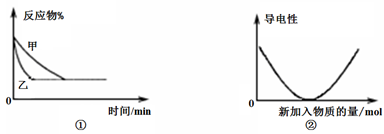 ?
?
A.图①可表示温度对“A2(g) + 3B2(g) 2AB3(g)△H<0”的影响
2AB3(g)△H<0”的影响
B.图①可表示压强对2A(g) + 2B(g) 3C(g) +D(s)的影响
3C(g) +D(s)的影响
C.图②可表示醋酸溶液中通入氨气至过量,溶液导电性的变化
D.图②可表示Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
参考答案:D
本题解析:A、乙到达平衡的时间短,说明乙温度高,因为该反应正反应方向为放热反应,平衡向逆反应方向移动,反应物的百分含量增大,错误;B、乙到达平衡的时间短,说明乙压强大,平衡向气体系数减小的方向,即正反应方向移动,反应物的百分含量减小,错误;C、醋酸溶液中通入氨气至过量, 首先醋酸与NH3反应生成强电解质CH3COONH4,溶液导电性增强,错误;D、Ba(OH)2溶液中滴加稀硫酸,Ba(OH)2与H2SO4反应,生成BaSO4沉淀和H2O,溶液的导电性减弱,完全反应后再加入H2SO4,H2SO4过量,溶液的导电性再逐渐增强。
本题难度:一般
5、选择题 下列物质属于电解质,而且可以导电的是( )
A.KCl固体
B.盐酸
C.乙醇
D.熔融的氧化铝
参考答案:A.KCl在水溶液中或熔融状态下能导电,是电解质;固体中有钾离子和氯离子,因没有自由移动的离子,不能导电,故A错误;
B.盐酸是氯化氢的水溶液,是混合物,不是化合物,所以不是电解质,故B错误;
C.乙醇是化合物,但其水溶液只存在乙醇分子,不导电,属于非电解质,故C错误;
D.熔融的氧化铝,是化合物,属于电解质,电离出自由移动的铝离子和氧离子,能导电,故D正确;
故选D.
本题解析:
本题难度:简单