时间:2020-08-23 08:01:02
1、填空题 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: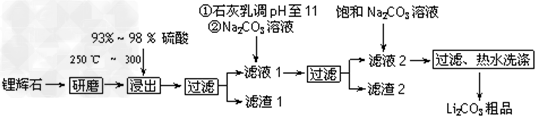
已知:①?Li2O·Al2O3·4SiO2?+H2SO4(浓)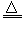 Li2SO4+Al2O3·4SiO2·H2O↓ ?
Li2SO4+Al2O3·4SiO2·H2O↓ ?
②?某些物质的溶解度(S)如下表所示。 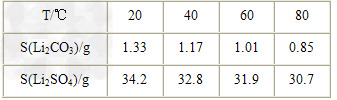
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是__________________________。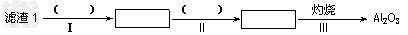
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_______________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是__________________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①?a中,阳极的电极反应式是___________________。
②为什么要用离子选择透过膜隔开________________(任写一点)
③?b中,生成Li2CO3反应的化学方程式是__________________。
参考答案:(1)Al3++3NH3·H2O = Al(OH)3↓+3NH4+
(2)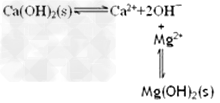 ?
?
(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失
(4)① 2Cl-―2e- = Cl2↑;②防止氯气与氢氧化锂反应,使产品不纯,防止氯气与氢气发生反应,引起爆炸;③?2LiOH+NH4HCO3 = Li2CO3+NH3+2H2O
本题解析:
本题难度:一般
2、填空题 工业上制备BaCl2的工艺流程图如图7: 某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。? 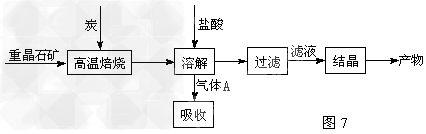
已知:BaSO4(s)?+?4C(s)? 4CO(g)?+?BaS(s)?△H1?=?+571.2?kJ·mol-1?①
4CO(g)?+?BaS(s)?△H1?=?+571.2?kJ·mol-1?①
BaSO4(s)?+?2C(s)? 2CO2(g)?+?BaS(s)?△H2=?+226.2?kJ·mol-1?②
2CO2(g)?+?BaS(s)?△H2=?+226.2?kJ·mol-1?②
(1)高温焙烧时常把原料粉碎,目的是_________________________________
(2)常温下,相同浓度的Na2S和NaHS溶液中,说法正确的是:____________
A.?Na2S溶液的pH比NaHS溶液pH大
B.?两溶液中含有的离子种类不同
C.?两溶液中滴入同体积同浓度的盐酸,产生气体速率相?等
D.?两溶液中加入NaOH固体,c(S2-)都增大
E.?NaHS溶液中:c(Na+)?>?c(HS-)?>?c(OH-)?>?c(H+)?>?c(S2-)
(3)反应C(s)?+?CO2(g) ?2CO(g)的△H?=?___________
?2CO(g)的△H?=?___________
(4)制备BaCl2的工艺流程图?中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为:_________________
(5)实际生产中必须加入过量的炭,同时还要通入空气,目的是:________________(写出一种原因即可)。
参考答案:(1)增大反应物的接触面积,加快反应速率
(2)ADE?
(3)+172.5?kJ·mol-1?
(4)S2-?+?H2O?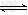 HS-?+?OH-?
HS-?+?OH-?
(5)使BaSO4得到充分还原(或C和O2反应放热维持反应所需高温)
本题解析:
本题难度:一般
3、选择题 关于天然气的下列说法中不正确的是
[? ]
A.天然气和沼气的主要成分都是甲烷
B.天然气燃烧的产物中,SO2含量少
C.天然气与空气混合点燃不会发生爆炸
D.改液化石油气为天然气作燃料,燃烧时减少进空气量或增大进天燃气量
参考答案:C
本题解析:
本题难度:简单
4、填空题 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是__________,_________反射炉内生成炉渣的主要成分是____;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是____;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极____(填图中的字母);在电极d上发生的电极反应式为______;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____。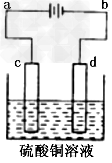
参考答案:(1)2Cu2FeS2+O2 Cu2S+2FeS+?SO2;2FeS+3O2
Cu2S+2FeS+?SO2;2FeS+3O2 2FeO+2SO2;FeSiO3
2FeO+2SO2;FeSiO3
(2)2Cu2S+3O2 2Cu2O+2SO2、2Cu2O+?Cu2S
2Cu2O+2SO2、2Cu2O+?Cu2S 6Cu+?SO2↑
6Cu+?SO2↑
(3)c;Cu2++2e-=Cu;Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中
本题解析:
本题难度:一般
5、填空题 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程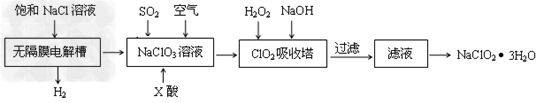
已知:
①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。 ?
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式:____________________。
(2)反应生成ClO2气体需要X酸酸化的原因为:________X酸为_________。
(3)吸收塔内的温度不能过高的原因为:____________________________
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2-或Cl-。ClO2被S2-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。请写出pH≤2时ClO2与S2-反应的离子方程式: 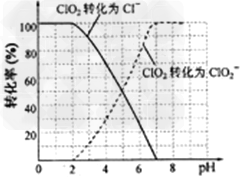
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为:____________________。
(6)从滤液中得到NaClO2·3H2O粗晶体的操作步骤为_______?、_______、________。
参考答案:(1)Cl-+6e-+6OH-==ClO3-+3H2O
(2)ClO2只能在酸性环境中存在;硫酸
(3)防止H2O2分解
(4)2ClO2+5S2-+?8H+?==2Cl-+5S↓+4H2O?
(5)稀释ClO2气体,防止爆炸
(6)蒸发浓缩、冷却结晶、过滤
本题解析:
本题难度:一般