时间:2020-08-23 07:52:13
1、填空题 我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖。
(1)基态Fe2+的核外电子排布式为_________________。
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是__________(用相应的元素符号填空)。
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F=(NH4)3FeF6+3NH4SCN。
①(NH4)3FeF6存在的微粒间作用力除共价键外还有_________(选填序号,下同)。
a.配位键? b.氢键? c.金属键? d.离子键
②已知SCN一中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为_____________,该原子团中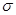 键与
键与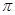 个数的比值为___________________。
个数的比值为___________________。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000oC,试解释两种化合物熔点差异较大的原因:_______________________________。
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的。
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右图所示,则Y轴可表示的氢化物(RH3)性质可能有________。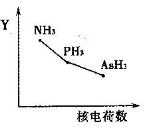
a.稳定性? b.沸点?c.R—H键能?d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为______。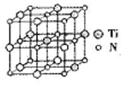
参考答案:(1)[Ar]3d6(2分) (2)F>O>As(1分)
(3)①ad(2分,漏选扣1分,错选不得分) ②sp(1分)? 1:1(1分)
(4)FeF3为离子晶体,FeCl3为分子晶体(2分,答案合理即可得分)
(5)①ac(2分,漏选扣1分,错选不得分)?②Ti4CN3(2分)
本题解析:(1)亚铁离子的核外电子数是24,因此根据核外电子的排布规律可知,基态Fe2+的核外电子排布式为[Ar]3d6。
(2)非金属性越强,电负性越大,则根据元素周期律可知氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As。
(3)①(NH4)3FeF6是离子化合物,存在的微粒间作用力除共价键外还有离子键,另外还有配位键,即N和H、Fe与F之间存在配位键,答案选ad。
②已知SCN一中各原子最外层均满足8电子稳定结构,则碳元素分别与S以及N元素形成1个双键,不存在孤对电子,因此C原子的杂化方式为sp杂化;由于单键都是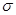 键,双键是由1个
键,双键是由1个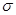 键与1个
键与1个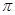 键构成的,则该原子团中
键构成的,则该原子团中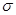 键与
键与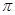 个数的比值为1:1。
个数的比值为1:1。
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,这说明氯化铁形成的晶体是分子晶体,而FeF3晶体熔点高于1000oC,这说明氟化铁形成的晶体类型是离子晶体,因此两种化合物熔点差异较大的原因是FeF3为离子晶体,FeCl3为分子晶体。
(5)①a.非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;c .非金属性越强与氢元素形成的共价键越强,键能越大,因此R—H键能虽原子序数的增大而减小,c正确;d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确,答案选ac。
②根据晶胞的结构特点并依据均摊法可知,晶胞中含有的碳原子数是8×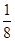 =1,氮原子数6×
=1,氮原子数6×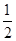 =3,钛原子数是12×
=3,钛原子数是12×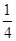 +1=4,所以化学式为Ti4CN3。
+1=4,所以化学式为Ti4CN3。
本题难度:困难
2、填空题 请根据题意回答下列问题:
Ⅰ、当甲烷的四个氢被甲基替换后,得到新戊烷,新戊烷的所有氢原子再被甲基替换得到新的烷烃,…
(1)请写出甲烷电子式______.
(2)请将新戊烷用系统命名法命名______.
(3)试写出甲烷按上述方法连续进行三次甲基替换操作后所得烷烃的分子式______
Ⅱ、肉桂酸在食品、医药化工等方面都有应用.肉桂酸只含有碳、氢、氧三种元素,其结构模型如图.
(4)与肉桂酸互为同分异构体,且符合下列条件的同分异构体有______种(①含有苯环,②属于酯类,③苯环上只有1个取代基).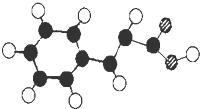
参考答案:(1)因碳原子的最外层有4个电子,氢原子最外层1个电子,一个碳原子形成4对共用电子对,一个氢原子形成一对共用电子对,所以电子式为: ;故答案为:
;故答案为: ;
;
(2)新戊烷[(CH3)4C]的系统命名为:2,2-二甲基丙烷,故答案为:2,2-二甲基丙烷;
(3)第一次甲基替换操作后多了4个碳原子、第二次甲基替换操作后多了12个碳原子、第甲基替换操作后多了36个碳原子,此时分子共53个碳原子,根据烷烃的通式得出分子式为C53H108,故答案为:C53H108;
(4)肉桂酸结构简式为 ,根据其同分异构体符合:①含有苯环,②属于酯类,③苯环上只有1个取代基,说明分子中含有1个-酯基,1个双键,同分异构体为:C6H5OOCCH=CH2、C6H5COOCH=CH2,C6H5CH=CHOOCH,C6H5(OOCH)CH=CH2,共4种,故答案为:4;
,根据其同分异构体符合:①含有苯环,②属于酯类,③苯环上只有1个取代基,说明分子中含有1个-酯基,1个双键,同分异构体为:C6H5OOCCH=CH2、C6H5COOCH=CH2,C6H5CH=CHOOCH,C6H5(OOCH)CH=CH2,共4种,故答案为:4;
本题解析:
本题难度:一般
3、选择题 关于Na元素和F元素的叙述正确的是( )
A.原子半径Na<F
B.原子序数Na>F
C.原子的电子层数Na<F
D.原子最外层电子数Na>F
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列化学用语表达正确的是( )
A.一氯乙烷的结构式CH3Cl
B.丁烷的结构简式CH3(CH2)2CH3
C.四氯化碳的电子式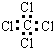
D.苯的分子式
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列每组中各物质内既有离子键又有共价键的一组是
[? ]
A.NaOH、H2SO4、(NH4)2SO4
B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
参考答案:C
本题解析:
本题难度:简单