时间:2020-08-23 07:46:59
1、简答题 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.
请回答下列问题:
(1)X元素在周期表中的位置是______.
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入______(填物质名称);负极电极反应式为______.
(3)C在一定条件下反应生成A的化学方程式是______.
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法中,正确的是______(填写下列各项的序号).
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大.
参考答案:X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体;?短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),判断为氢氧燃料电池,X、Y、Z三种短周期元素,它们的原子序数之和为16,XZ为O2、H2结合转化关系判断,Y原子序数为7,X为N元素,X+Z=B;Z+Y=A,一个B分子中含有的Z原子个数比C分子中少1个,说明Z元素为H,则X、Y、Z分别为O、N、H,A、B、C分别为NO、H2O、NH3;
(1)X为氧元素,元素周期表中位于第2周期,ⅥA族,故答案为:2周期,ⅥA族;
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,是氢氧燃料电池,负极为氢气发生氧化反应,正极为正极发生还原反应,所以正极反应为:氧气;负极电极反应式为:H2+2OH-=2H2O+2e-;
(3)C为NH3在一定条件下反应生成A为NO,是氨气的催化氧化,反应的化学方程式:4NH3+5O2?高温?.催化剂4NO+6H2O,故答案为:4NH3+5O2?高温?.催化剂4NO+6H2O;
(4)Y的单质(N2)与Z的单质(H2)生成C(NH3)的反应是可逆反应,△H<0,反应为:N2+3H2催化剂.高温高压2NH3;,△H<0;
a、化学平衡的标志是正逆反应速率相同,故a正确;
b、将等物质的量的Y(N2)、Z(H2)的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应,设起始量都为1mol,则
? N2+3H2催化剂.高温高压2NH3
起始量? 1? 1? 0
变化量? x? 3x? 2x
平衡量 1-x? 1-3x? 2x
所以氮气所占体积分数为物质的量的百分数=1-x2-2x×100%=50%,所以Y(N2)的单质的体积分数始终为50%,故b正确;
c、达到化学平衡时,Y(N2)的单质的体积分数始终为50%,H2和NH3共占50%,所以两种单质在混合气体中的物质的量之比不为1:1,故c错误;
d、达到化学平衡的过程中,气体质量不变,气体物质的量减小,所以混合气体平均相对分子质量增大,故d错误;
e、到化学平衡后,再升高温度,反应是放热反应,平衡逆向进行,C(NH3)的体积分数减小.故e错误;
故选ab.
本题解析:
本题难度:一般
2、填空题 (6分)室温下,单质A.B、C分别为金属单质、黄绿色气体、无色气体,在一定的条件下,它们可以按下列框图进行反应。又知D溶液是黄色的。请回答:
(1)写出下列物质的化学式:A________________,B____________。
(2)反应①的化学方程式:________________________________。
(3)反应④的离子方程式:________________________________。
参考答案:(6分) (1)Fe? ? Cl2 ?(每空1分)
(2)2Fe+3Cl2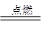 2FeCl3?(2分)
2FeCl3?(2分)
(3) 2Fe2++Cl2===2Fe3++2Cl-?(2分)
本题解析:本题是无机框图题,关键是找准突破点。单质A.B、C分别为金属单质、黄绿色气体、无色气体,所以B一定是氯气,则C应该是氢气,E是氯化氢。又知D溶液是黄色的,所以D是氯化铁,则A是铁。铁与盐酸反应又生成氢气和氯化亚铁,氯化亚铁被氯气氧化则生成氯化铁,即F是氯化亚铁。
本题难度:一般
3、简答题 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
(1)反应①的基本反应类型是______;
(2)C的化学式为______;
(3)写出物质E和B在加热条件下反应的化学方?程式______;
(4)将浅绿色溶液D转化为黄色溶液的方法是(用离子方程式表示)______.
(5)乙醇在A作催化剂的条件下可以被空气中的氧气催化氧化,试写出该反应的化学方程式:______.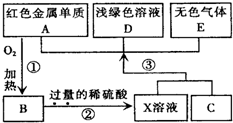
参考答案:由A为红色金属单质,则A为Cu,由反应①可知B为CuO,由反应②X为硫酸铜、硫酸混合溶液,由反应③X溶液+C→A+D+E,且D为浅绿色溶液(含有Fe2+),E为无色气体,故C为Fe,D为FeSO4,E为H2,
(1)反应①是2Cu+O2?点燃?.?2CuO,属于化合反应,故答案为:化合反应;
(2)由上述分析可知,C为Fe,故答案为:Fe;
(3)H2和CuO在加热条件下反应是Cu与H2O,反应方程式为:H2+CuO?△?.?Cu+H2O,故答案为:H2+CuO?△?.?Cu+H2O;
(4)利用强氧化剂将浅绿色FeSO4溶液转化为黄色Fe2(SO4)3溶液,如加入氯水等,反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)乙醇在Cu作催化剂的条件下可以被空气中的氧气催化氧化生成乙醛与水,该反应的化学方程式为:2CH3CH2OH+O2Cu
本题解析:
本题难度:一般
4、简答题 已知①~④均为工业生产及应用的常见反应.其中常温下B、D、J、P气体,E为分子中原子个数比为1:l的液体.A的相对分子质量为120.(个别反应的产物已略去)
试回答下列问题:
(1)反应F与N溶液反应的离子方程式为______;
(2)反应⑤中当有1mol电子转移时,氧化剂消耗______g;
(3)反应④的离子方程式为______;如图2是该反应原理的示意图,该装置中使用的是______(填“阴”或“阳”)离子交换膜,图中从d处收集到的是______.
(4)工业上由D制取I的过程可表示为:
由D与B反应生成X的反应所用的设备是______;
①高炉?②沸腾炉?③接触室?④分馏塔?⑤吸收塔
已知400℃101Kpa时,2D(g)+B(g?2X(g);△H=-196.6KJ/mol,当2mol?D与1mol?B在该条件下反应达平衡时反应放热186.8KJ.在实际生产中综合考虑各种因素,为提高D的转化率,工业选择了以下哪些条件______.
①适当升高温度?②增大压强?③使用合适的催化剂? ④及时移走生成物?
⑤适当增大B的浓度?⑥将反应物与生成物在热交换器中进行热交换.
参考答案:(1)反应F(Al)与N(NaOH)溶液反应的离子方程式为:2Al+2OH-+2H20=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H20=2AlO2-+3H2↑;
(2)反应⑤为H2O2+SO2=H2SO4,1mol氧化剂H2O2发生反应,电子转移2mol,中当有1mol电子转移时氧化剂H2O2物质的量0.5mol,质量=0.5mol×34g/mol=17g;故答案为:17g;
(3)反应④是电解食盐水的反应,反应的离子方程式为:2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-;该装置中使用的是阳离子交换膜,阴极d处收集到的是NaOH溶液;
故答案为:2Cl-+2H2O?电解?.?Cl2↑+H2↑+2OH-? NaOH溶液;
(4)由D(SO2)与B(O2)反应生成X(SO3)的反应,是二氧化硫气体的催化氧化,在接触室中进行,反应为2SO2(g)+
O2(g)?2SO3(g);△H=-196.6KJ/mol;为提高SO2的转化率,需要平衡正向进行,在实际生产中综合考虑各种因素分析;
①反应是放热反应,升温平衡逆向进行,二氧化硫转化率减小,故①错误;
②增大压强平衡向气体体积减小的方向进行,二氧化硫转化率增大,但高温催化剂作用下二氧化硫转化率已经很高,增大压强提高不大,故②错误;
③催化剂只改变速率,不改变平衡,故③错误;
④及时移走生成物,平衡正向进行,二氧化硫转化率增大,④正确;
⑤适当增加氧气的浓度会提高二氧化硫的转化率,故⑤正确;
⑥将反应物与生成物在热交换器中进行热交换,是反应产生的温度降低,促进平衡正向进行,故⑥正确;
故选④⑤⑥;
故答案为:③;④⑤⑥;
本题解析:
本题难度:一般
5、推断题 在下图所示的物质转化关系中,A是常见气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)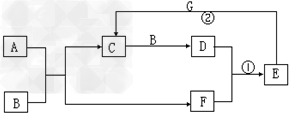
请回答下列问题:
(1)B的化学式为______________。
(2)A的电子式为______________。
(3)反应①的化学方程式为____________________。
(4)反应②的离子方程式为__________________。
参考答案:(1)O2
(2)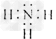
(3)
(4)
本题解析:
本题难度:一般