时间:2020-08-23 07:45:30
1、选择题 下列图示中错误的实验操作是?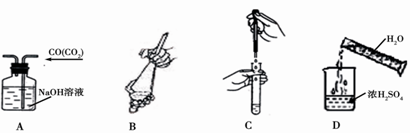
A.除去CO中的CO2
B.萃取时振荡混合液
C.向试管中滴加液体
D.稀释浓硫酸
2、选择题 下列叙述Ⅰ和Ⅱ均正确且有因果关系的是(? )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| C | SiO2与HF反应 | 氢氟酸不能保存在玻璃瓶中 |
| D | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
3、选择题 下列实验操作中,正确的是
[? ]
①.把pH试纸浸入待测溶液中,测定溶液的pH
②.用渗析法除去Fe(OH)3胶体中的Cl-离子
③.苯酚沾在皮肤上,应立即用酒精清洗
④.称NaOH固体质量时,将NaOH固体放在垫有滤纸的托盘上进行称量
⑤.用分液漏斗分离除去溴苯中混入的溴
⑥.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦.用酒精萃取碘水中的碘
A.①②⑥
B.②③⑥
C.②⑤⑦
D.②④⑥
4、选择题 用铂丝蘸取碳酸钠在火焰上灼烧,可以观察到的颜色是?(?)
A.紫色
B.黄色
C.红色
D.氯色
5、选择题 下列与实验相关的叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.配制1 mol·L-1300mLNaCl溶液可以选择一个50mL的容量瓶和一个250 mL的容量瓶
D.可以用下图装置进行氯气的尾气处理