时间:2020-08-23 07:39:52
1、选择题 下列有关实验操作的说法中,不正确的是
A.因苯酚具有弱酸性,如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗
B.在做乙烯的制备实验时要加少量的碎瓷片,以防止溶液暴沸
C.振荡试管中的液体时,应用手指拿住试管,用手腕甩动
D.中学阶段在使用试纸时,必须先用蒸馏水湿润,然后再将待测液滴到试纸上,看变化的结果,但是PH试纸除外,在使用它时不能先用蒸馏水湿润.
2、选择题 下列物质的检验方法正确的是
A.碘——淀粉
B.H+——酚酞
C.OH-——蓝色石蕊试纸
D.Cl-——盐酸酸化的硝酸银溶液
3、选择题 实验室中,有关试剂的保存方法错误的是(?)
A.烧碱溶液保存在磨口玻璃塞的试剂瓶中
B.液溴用水封保存
C.少量金属钠保存在煤油中
D.浓硝酸保存在棕色细口瓶中
4、实验题 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO4—+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.稀硫酸
B.浓硝酸
C.稀硝酸
D.稀盐酸
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)。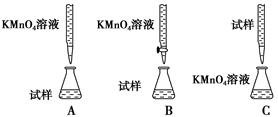
方案二 重量法 操作流程如下: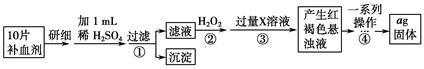
(4)步骤②中除用H2O2外还可以使用的物质是__________________________。
(5)步骤②是否可以省略________,理由是________________________________
_______________________________________。
(6)步骤④中一系列操作依次是:过滤、洗涤、________、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量________g(用含a的代数式表示)。
5、实验题 现行中学教材中,有以下化学实验:
A.溴乙烷的水解? B.浓硫酸跟乙醇反应制乙烯? C.乙醛还原新制的氢氧化铜;
D.乙酸乙酯的制取? E.石油的蒸馏? F.葡萄糖的银镜反应? G.乙酸乙酯的水解。
对以上实验,按下列各操作的要求,用字母A、B、C…完成以下填空:(多填扣分)
(1)需用水浴加热的是?;
(2)实验装置不需要检查气密性的是? ?;
?;
(3)为防止液体暴沸,常需加少量碎瓷片的是?;
(4)需用温度计的是?。