时间:2020-08-23 07:18:24
1、填空题 25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
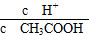 ? C.c(H+)·c(OH-)? D.
? C.c(H+)·c(OH-)? D.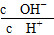
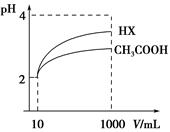
2、选择题 下列实验方案不能成功的是(?)
A.通过测浓度均为0.01 mol/L的溶液的pH大小来鉴别盐酸和乙酸?
B.向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质?
C.加热蒸发FeCl3溶液制备FeCl3晶体?
D.测均为0.1 mol/L的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质
3、填空题  (10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(10分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(1)若溶液中只溶解了一种溶质,该溶质是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
(2)若上述关系中D是正确的,混合后溶液中的溶质为 。
(3)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则混合前a b(填“>”、“<”、或“=”), 用a、b表示NH3·H2O的电离平衡常数为 。
4、简答题 相同温度下的0.1摩/升和0.01摩/升CH3COOH溶液中,CH3COOH的电离度( )
A.大于
B.小于
C.等于
D.不能肯定
5、选择题 H2SO3、H2CO3分别属于中强酸和弱酸,H2SO3 ?H+ + HSO3-? HSO3-
?H+ + HSO3-? HSO3- ?H+ + SO32-? H2CO3
?H+ + SO32-? H2CO3 ?H+ + HCO3-;HCO3-
?H+ + HCO3-;HCO3- ?H+ + CO32-;已知K1 > K1" ≈ K2 > K2",则溶液中不可以大量共存的离子组合是(?)
?H+ + CO32-;已知K1 > K1" ≈ K2 > K2",则溶液中不可以大量共存的离子组合是(?)
A.SO32-、HCO3-
B.HSO3-、CO32-
C. SO32-、CO32-
D.HSO3-、HCO3-