时间:2020-08-23 07:15:58
1、选择题 有甲、乙两种溶液,甲溶液的pH是乙溶液pH的2倍,则甲、乙两溶液中的C(H+)
A 2:1 B 100:1 C 1:100 D 无法确定
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列电离方程式书写正确的是
[? ]
A.NaHSO4=Na++H++SO42-
B.NaHCO3=Na++H++CO32-
C.CH3COOH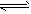 CH3COO-+H+
CH3COO-+H+
D.H2CO3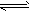 2H++CO32-
2H++CO32-
参考答案:AC
本题解析:
本题难度:简单
3、实验题 滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
①下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
②该学生的实验操作如下:
A、用碱式滴定管取稀NaOH 25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
B、用待测定的溶液润洗碱式滴定管。
C、用蒸馏水洗干净滴定管。
D、取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E、检查滴定管是否漏水。
F、另取锥形瓶,再重复操作一次。
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a. 滴定操作的正确顺序是(用序号填写)___________________________ 。
b. 在G操作中如何确定终点? __________________________ ____ 。
c. 若换酚酞做指示剂,如何确定终点? _________________________ ____ 。
(2)氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积 (mL)[来 | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
参考答案:
本题解析:
本题难度:一般
4、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度关系正确的是
A.c(NH4+)+ c(H+) =c(OH-)
B.c(Na+)=c(Cl-)>c(H+)=c(OH-)
C.c(NH4+)+c(NH3·H2O) =2c(Cl-)
D.c(NH4+) >c(NH3·H2O)>c(OH-)>c(H+)
参考答案:A
本题解析:根据电荷守恒可知c(NH4+)+ c(H+) +c(Na+)=c(Cl-)+c(OH-) ,而c(Na+)=c(Cl-),所以选项A正确,B不正确,C中应该是c(NH4+)+c(NH3·H2O) =c(Cl-),D应该是c(NH4+) <c(NH3·H2O),答案选A。
本题难度:一般
5、选择题 下列各式中,属于电离方程式的是
[? ]
A. HCO3-+H2O H2CO3+OH-
H2CO3+OH-
B. HCO3-+H2O CO32-+H3O+
CO32-+H3O+
C. HCO3-+OH-==CO32-+H2O
D. HCO3-+H+==CO2↑+H2O
参考答案:B
本题解析:
本题难度:简单