时间:2020-08-23 07:11:26
1、推断题 下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
已知:①反应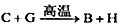 能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应:
能放出大量的热,该反应曾应用于铁轨的焊接;②I是一种常见的温室气体,它和E可以发生反应: ,F中E元素的质量分数为60%。
,F中E元素的质量分数为60%。 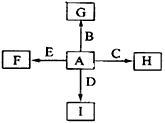
回答问题:
⑴①中反应的化学方程式为____________________;
⑵化合物I的电子式为_______________,它的空间结构是_______________;
⑶1.6gG溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需的铜粉的质量(写出离子方程式和计算过程)_________________;
⑷C与过量NaOH溶液反应的离子方程式为_______________,反应后溶于与过量化合物I反应的离子方程式为_______________________;
⑸E在I中燃烧观察到的现象是_______________。
2、填空题 (14分)下图中各方框中的字母表示有关的一种反应物或生成物(某些物质略去),其中常温下C为无色液体,B、D、G、I、J为气体,其中B可使湿润的红色石蕊试纸变蓝,A~N的所有物质中只有G为单质,其余为化合物。N为不溶于水的无机酸。
回答下列问题:
(1)A的名称为 ,E的电子式是 ;
(2)写出B + G → I的化学方程式?。
(3)写出Cu与K的稀溶液反应的离子方程式 : 。
: 。
(4)写出G的一种同素异形体的化学式: ,该物质与G在化学性质上的共同点是 。
(5)已知工业上生产0.1molB放出4.62kJ热量,写出该反应的热化学方程式:
。
(6)在反应C+E→G+F中,每生成1.5 molG转移 mol电子。
3、推断题 已知A是灰黑色的硬而脆的固体,B是气态物质,A~E各种物质的相互转化关系如下图所示。 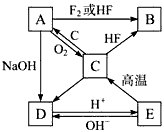
(1)写出B、D、E三种物质的化学式:B_________,D_________,E_________;
(2)画出A的原子结构示意图__________________;
(3)写出C→A的化学方程式__________________。
4、填空题 (13分)已知有以下物质相互转化,其中A为单质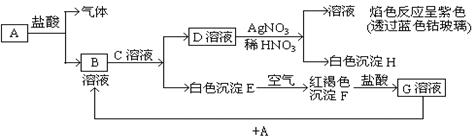
试回答:
(1)写出下列物质的化学式:
A? ?;B?; H?;F?
?;B?; H?;F?
(2)写出由A转变成B的离子反应方程式? ??
??
(3)写出用KSCN溶液鉴别G溶液的离子方程式?
(4)写出G溶液加入A的有关离子反应方程式?
5、填空题 (共12分)如图转化关系中A—H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
(1)写出下列反应的化学方程式:
A与B ____________________________________________________
Cu与H ___________________________________________________
F与甲____________________________________________________
(2)写出丙与D溶液反应的离子方程式 _______________________________________
(3)常温时H的浓溶液与丙物质并不能看到明显的反应现象,原因是_________?____
?。