时间:2020-08-23 07:11:26
1、填空题 (8分) 在室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下列框图进行反应。又知E溶液是无色溶液。请回答: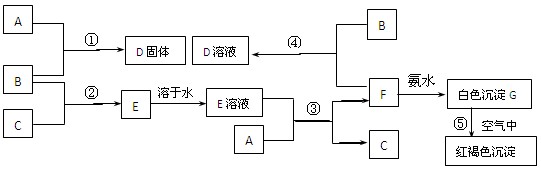
(1)? (用化学式填空)
A是______________B是________________
(2)反应①的化学方程式为___________________________________________
反应③的离子方程式为___________________________________________
反应⑤的化学方程式为___________________________________________________
2、实验题 有一种无色混合气体,可能含有CH4、NH3、H2、CO、CO2和HCl.进行如下实验:①此混合气体通过浓硫酸,气体体积不变;②再通入澄清石灰水,气体体积变小但无混浊现象;③剩余气体在空气中引燃,燃烧产物不能使无水硫酸铜变色。
(1)根据实验①,可推断混合气体中没有___________________,原因是____________________.
(2)根据实验③,可推断混合气体中没有__________________,原因是___________________.
(3)混合气体中肯定有__________________________________.
(4)上述实验_______________(填“有”或“没有”)不能肯定或否定的气体。若有。则是________________气体。
3、简答题 A、B、C、D和甲有以下转化关系.已知物质甲是短周期元素组成的盐,且是某种消毒液的有效成分,沉淀D可溶于酸.请回答下列问题:
(1)组成A的元素在周期表中位于第______?周期第______族.
(2)鉴定C中阳离子(不考虑H+)的操作和现象是______.
(3)A转化为B时会放出无色气体E,在298K时1mol?A完全反应放出热量QkJ,则该反应的热化学方程式为______.
(4)若A转化为C时无气体放出,写出该反应的化学方程式:______.
(5)写出溶液C和溶液甲反应的离子方程式:______.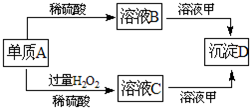
4、填空题 有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略)。已知A和B是单质,B、E、F 在常温下为气体,C为淡黄色粉末。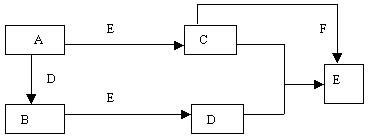
试回答:
(1)写出A、B、的化学式:A__________; B__________。
(2)写出C和D反应生成E 的化学方程式: _____________________________________。
(3)写出C和F反应生成E 的化学方程式:_____________________________________。
(4)写出C物质的电子式___________________,F的结构式 _____________________。
(5)用电子式表示D的形成过程:_______________________________。
5、填空题 有关物质A~H的转化关系如图所示: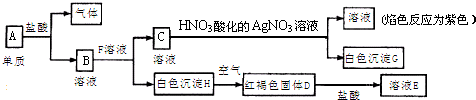
回答下列问题:
(1)写出下列物质的化学式:E______;F______;沉淀G______.
(2)A→B的离子方程式______.
(3)H→D的化学方程式______.
(4)E中金属阳离子的检验方法是______.